Les chercheurs de l'UC Santa Cruz ont découvert un peptide dans l'ARN humain qui régule l'inflammation et pourrait ouvrir une nouvelle voie au traitement de maladies telles que l'arthrite et le lupus. L'équipe a utilisé un processus de sélection basé sur le puissant outil d'édition de gènes CRISPR pour faire la lumière sur l'un des plus grands mystères de notre ARN, la molécule responsable de la transmission des informations génétiques contenues dans notre ADN.
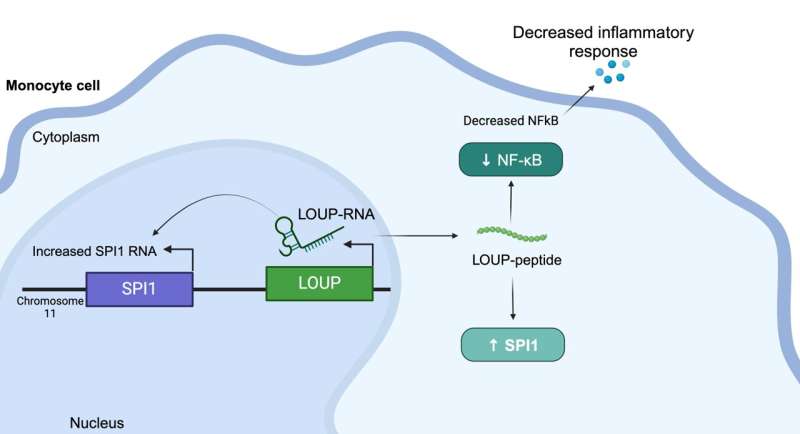
Ce peptide provient d’un long ARN non codant (lncRNA) appelé LOUP. Selon les chercheurs, le génome humain code pour plus de 20 000 ARNnc, ce qui en fait le plus grand groupe de gènes produits à partir du génome. Mais malgré cette abondance, les scientifiques savent peu de choses sur la raison pour laquelle les ARNnc existent ni sur ce qu’ils font. C'est pourquoi l'ARNnc est parfois appelé « la matière noire du génome ».
L'étude, publiée le 23 mai dans les Actes de l'Académie nationale des sciences (PNAS), est l’un des rares dans la littérature existante à percer les mystères de l’ARNnc. Il présente également une nouvelle stratégie pour effectuer un criblage à haut débit afin d’identifier rapidement les ARNnc fonctionnels dans les cellules immunitaires. L'approche de sélection groupée permet aux chercheurs de cibler des milliers de gènes en une seule expérience, ce qui constitue un moyen beaucoup plus efficace d'étudier des parties non caractérisées du génome que les expériences traditionnelles qui se concentrent sur un gène à la fois.
La recherche a été dirigée par l'immunologiste Susan Carpenter, professeur et présidente Sinsheimer du département de biologie moléculaire, cellulaire et développementale de l'UC Santa Cruz. Elle étudie les mécanismes moléculaires impliqués dans la protection contre les infections. Plus précisément, elle se concentre sur les processus qui conduisent à l’inflammation afin de déterminer le rôle que jouent les ARNnc dans ces voies.
"L'inflammation est un élément central de presque toutes les maladies", a-t-elle déclaré. "Dans cette étude, mon laboratoire s'est concentré sur la tentative de déterminer quels gènes d'ARNnc sont impliqués dans la régulation de l'inflammation."
Cela signifiait étudier les ARNnc dans un type de globule blanc appelé monocytes. Ils ont utilisé une modification de la technologie CRISPR/Cas9, appelée inhibition de CRISPR (CRISPRi), pour réprimer la transcription génétique et découvrir lesquels des lncARN d'un monocytes jouent un rôle dans sa différenciation en macrophage, un autre type de globules blancs essentiel à la survie. une réponse immunitaire qui fonctionne bien.
De plus, les chercheurs ont utilisé CRISPRi pour dépister l’implication de l’ARNnc des macrophages dans l’inflammation. De manière inattendue, ils ont localisé une région multifonctionnelle pouvant fonctionner comme un ARN et contenant un peptide non découvert qui régule l'inflammation.
Comprendre que ce peptide spécifique régule l'inflammation donne aux fabricants de médicaments une cible pour bloquer l'interaction moléculaire derrière cette réponse afin de la supprimer, a déclaré Carpenter. "Dans un monde idéal, vous concevriez une petite molécule pour perturber cette interaction spécifique, au lieu, par exemple, de cibler une protéine qui pourrait être exprimée dans tout le corps", a-t-elle expliqué. "Nous sommes encore loin de cibler ces voies avec ce niveau de précision, mais c'est certainement l'objectif. Les thérapies à base d'ARN suscitent actuellement beaucoup d'intérêt."
Les co-auteurs de l'étude de l'UC Santa Cruz incluent Haley Halasz, Eric Malekos, Sergio Covarrubias, Samira Yitiz, Christy Montano, Lisa Sudek et Sol Katzman, ainsi que des chercheurs de l'UCSF et du MIT.
Plus d'informations : Haley Halasz et al, les écrans CRISPRi identifient l'ARNnc, LOUP, comme un locus multifonctionnel régulant la différenciation des macrophages et la signalisation inflammatoire, Actes de l'Académie nationale des sciences (2024). DOI : 10.1073/pnas.2322524121
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par l'Université de Californie - Santa Cruz