En comparant les modèles d'expression génique de 26 espèces avec des durées de vie diverses, les biologistes de Rochester Vera Gorbunova et Andrei Seluanov ont découvert que les caractéristiques des différents gènes étaient contrôlées par des réseaux circadiens ou de pluripotence. Crédit :Illustration de l'Université de Rochester / Julia Joshpe
La sélection naturelle a produit des mammifères qui vieillissent à des rythmes radicalement différents. Prenez, par exemple, des rats-taupes et des souris nus; les premiers peuvent vivre jusqu'à 41 ans, soit près de dix fois plus longtemps que les rongeurs de taille similaire comme les souris.
Qu'est-ce qui explique la durée de vie plus longue? Selon de nouvelles recherches menées par des biologistes de l'Université de Rochester, une pièce clé du puzzle réside dans les mécanismes qui régulent l'expression des gènes.
Dans un article publié dans Cell Metabolism , les chercheurs, dont Vera Gorbunova, professeur de biologie et de médecine Doris Johns Cherry; Andrei Seluanov, professeur de biologie et de médecine; et Jinlong Lu, associé de recherche postdoctoral dans le laboratoire de Gorbunova et premier auteur de l'article, a étudié les gènes liés à la durée de vie. Leur recherche a découvert des caractéristiques spécifiques de ces gènes et a révélé que deux systèmes de régulation contrôlant l'expression des gènes - les réseaux circadiens et de pluripotence - sont essentiels à la longévité. Les résultats ont des implications à la fois pour comprendre comment la longévité évolue et pour fournir de nouvelles cibles pour lutter contre le vieillissement et les maladies liées à l'âge.
Comparer les gènes de longévité
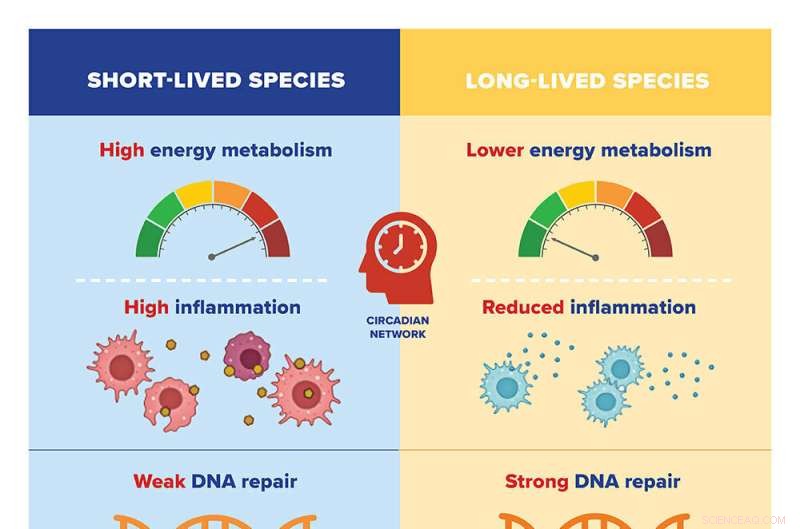
Les chercheurs ont comparé les modèles d'expression génique de 26 espèces de mammifères avec diverses durées de vie maximales, de deux ans (musaraignes) à 41 ans (rats-taupes nus). Ils ont identifié des milliers de gènes liés à la durée de vie maximale d'une espèce qui étaient positivement ou négativement corrélés à la longévité.
Ils ont découvert que les espèces à longue durée de vie ont tendance à avoir une faible expression des gènes impliqués dans le métabolisme énergétique et l'inflammation; et une expression élevée de gènes impliqués dans la réparation de l'ADN, le transport de l'ARN et l'organisation du squelette cellulaire (ou microtubules). Des recherches antérieures menées par Gorbunova et Seluanov ont montré que des caractéristiques telles qu'une réparation plus efficace de l'ADN et une réponse inflammatoire plus faible sont caractéristiques des mammifères à longue durée de vie.
L'inverse était vrai pour les espèces à courte durée de vie, qui avaient tendance à avoir une expression élevée des gènes impliqués dans le métabolisme énergétique et l'inflammation et une faible expression des gènes impliqués dans la réparation de l'ADN, le transport de l'ARN et l'organisation des microtubules.
Deux piliers de la longévité
Lorsque les chercheurs ont analysé les mécanismes qui régulent l'expression de ces gènes, ils ont trouvé deux grands systèmes en jeu. Les gènes négatifs de la durée de vie, ceux impliqués dans le métabolisme énergétique et l'inflammation, sont contrôlés par des réseaux circadiens. Autrement dit, leur expression est limitée à une heure particulière de la journée, ce qui peut aider à limiter l'expression globale des gènes chez les espèces à longue durée de vie.
Cela signifie que nous pouvons exercer au moins un certain contrôle sur les gènes négatifs de la durée de vie.
"Pour vivre plus longtemps, nous devons maintenir des horaires de sommeil sains et éviter l'exposition à la lumière la nuit, car cela peut augmenter l'expression des gènes négatifs de la durée de vie", déclare Gorbunova.
D'autre part, les gènes positifs à la durée de vie - ceux impliqués dans la réparation de l'ADN, le transport de l'ARN et les microtubules - sont contrôlés par ce qu'on appelle le réseau de pluripotence. Le réseau de pluripotence est impliqué dans la reprogrammation des cellules somatiques - toutes les cellules qui ne sont pas des cellules reproductrices - en cellules embryonnaires, qui peuvent plus facilement rajeunir et se régénérer, en reconditionnant l'ADN qui se désorganise avec l'âge.
"Nous avons découvert que l'évolution a activé le réseau de pluripotence pour atteindre une durée de vie plus longue", déclare Gorbunova.
Le réseau de pluripotence et sa relation avec les gènes positifs de la durée de vie est donc "une découverte importante pour comprendre comment la longévité évolue", déclare Seluanov. "En outre, cela peut ouvrir la voie à de nouvelles interventions anti-âge qui activent les principaux gènes positifs de la durée de vie. Nous nous attendrions à ce que les interventions anti-âge réussies incluent l'augmentation de l'expression des gènes positifs de la durée de vie et la diminution de l'expression des gènes négatifs de la durée de vie."