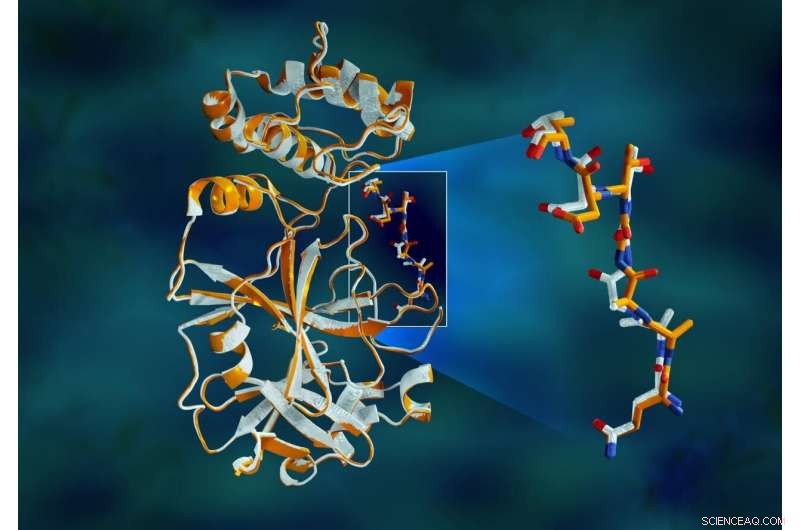
Le chevauchement des données de rayons X de la protéase principale du SRAS-CoV-2 montre des différences structurelles entre la protéine à température ambiante (orange) et la structure cryogéniquement congelée (blanc). Crédit :Jill Hemman/ORNL, Département américain de l'énergie
Une équipe de chercheurs des laboratoires nationaux d'Oak Ridge et d'Argonne du ministère de l'Énergie a effectué les premières mesures aux rayons X à température ambiante sur la protéase principale du SRAS-CoV-2, l'enzyme qui permet au virus de se reproduire.
Les mesures aux rayons X marquent une première étape importante dans l'objectif ultime des chercheurs de construire un modèle 3D complet de la protéine enzymatique. Le modèle sera utilisé pour faire avancer les simulations de calcul intensif visant à trouver des inhibiteurs de médicaments pour bloquer le mécanisme de réplication du virus et aider à mettre fin à la pandémie de COVID-19. Les résultats de leurs recherches sont accessibles au public et ont été publiés dans la revue Communication Nature .
Le SARS-CoV-2 est le virus qui cause la maladie COVID-19. Le virus se reproduit en exprimant de longues chaînes de protéines qui doivent être coupées en plus petites longueurs par l'enzyme protéase.
"La protéase est indispensable au cycle de vie du virus. La protéine a la forme d'un cœur de Saint-Valentin, mais c'est vraiment le cœur du virus qui lui permet de se répliquer et de se propager. Si vous inhibez la protéase et arrêtez le cœur, le virus ne peut pas produire les protéines essentielles à sa réplication. C'est pourquoi la protéase est considérée comme une cible médicamenteuse si importante, " a déclaré Andrey Kovalevsky de l'ORNL, auteur correspondant. Alors que la structure est connue à partir de cristaux conservés cryogéniquement, "C'est la première fois que la structure de cette enzyme est mesurée à température ambiante, ce qui est important car il est proche de la température physiologique où les cellules fonctionnent. »
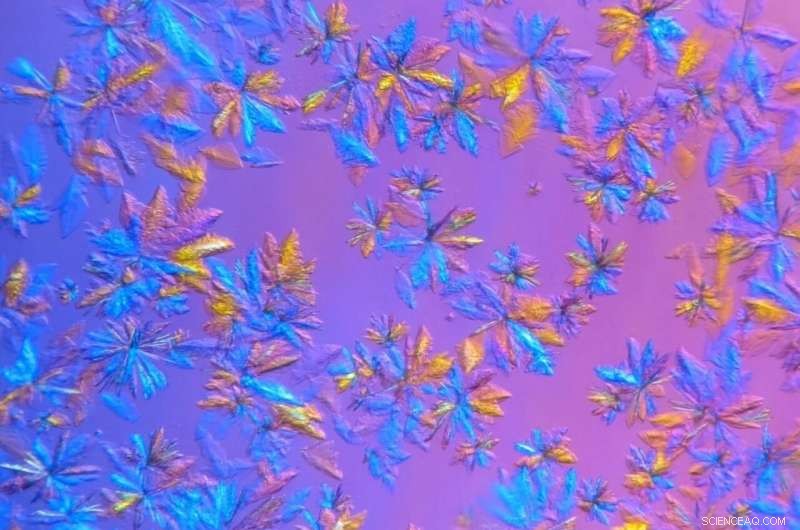
Cristaux de protéase SARS-CoV-2, cultivé dans le laboratoire de cristallisation et de caractérisation des protéines de l'ORNL et représenté en vue microscopique, sera utilisé dans des expériences de diffusion des rayons X. Crédit :Daniel Kneller/ORNL, Département américain de l'énergie
Construire un modèle complet de la structure de la protéine nécessite d'identifier chaque élément au sein de la structure et comment ils sont organisés. Les rayons X sont parfaits pour détecter les éléments lourds comme le carbone, atomes d'azote et d'oxygène. En raison de l'intensité des faisceaux de rayons X dans la plupart des installations synchrotron à grande échelle, les échantillons biologiques doivent généralement être congelés cryogéniquement à environ 100 K, ou environ moins 280 degrés Fahrenheit, pour résister au rayonnement assez longtemps pour que les données soient collectées.
Pour prolonger la durée de vie des échantillons de protéines cristallisées et les mesurer à température ambiante, Les chercheurs de l'ORNL ont fait pousser des cristaux plus gros que nécessaire pour les études cryogéniques synchrotron et ont utilisé une machine à rayons X interne dotée d'un faisceau moins intense.
"La culture de cristaux de protéines et la collecte de données sont un processus fastidieux et chronophage. Dans le temps qu'il faut généralement pour préparer et expédier l'échantillon à un synchrotron, nous avons pu faire pousser les cristaux, prendre les mesures et commencer à analyser les données, " a déclaré Daniel Kneller de l'ORNL, le premier auteur de l'étude. "Et, quand il y a une pandémie avec de nombreux scientifiques qui se mobilisent pour étudier ce problème, il n'y a pas un jour à perdre."
L'enzyme protéase est constituée de chaînes d'acides aminés avec un motif répétitif d'atomes d'azote-carbone-carbone qui forment l'épine dorsale de la protéine. Groupes latéraux des blocs de construction d'acides aminés, ou "résidus, " s'étendent de chacun des atomes de carbone du squelette central. L'enzyme est repliée dans une forme 3-D spécifique, créant des poches spéciales où une molécule de médicament s'attacherait.
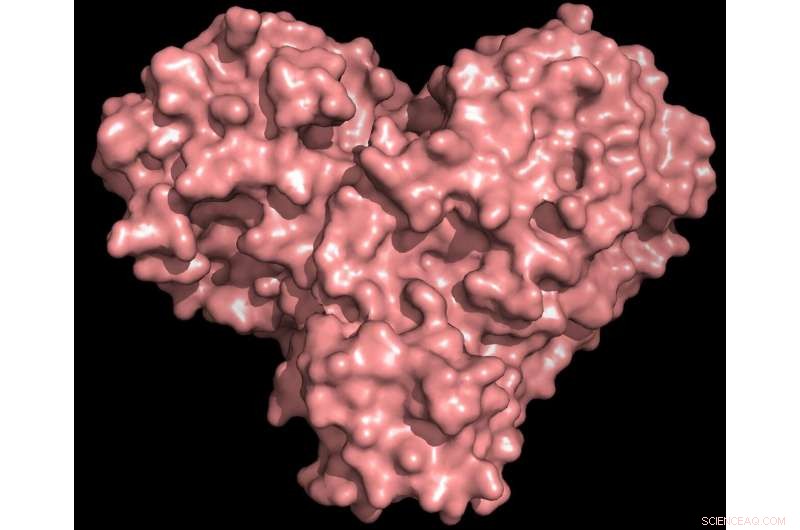
La protéine protéase a à la fois la forme d'un cœur et fonctionne comme un seul, permettant au virus de se répliquer et de se propager. L'inhibition de la protéase bloquerait la reproduction du virus. Crédit : Crédit :Andrey Kovalevsky/ORNL, Département américain de l'énergie
L'étude a révélé d'importantes disparités structurelles entre les orientations du squelette et certains des résidus dans les échantillons à température ambiante et cryogéniques. La recherche suggère que la congélation des cristaux peut introduire des artefacts structurels qui pourraient entraîner une compréhension moins précise de la structure de la protéase.
Les résultats de l'équipe sont partagés avec les chercheurs, dirigé par le président du gouverneur ORNL-Université du Tennessee Jeremy Smith, qui effectuent des simulations d'amarrage de drogue à l'aide de Summit at ORNL, le superordinateur le plus rapide du pays.
"Ce que les chercheurs font sur Summit, c'est de prendre des composés médicamenteux connus et d'essayer de les lier par ordinateur à la principale protéase pour la réutilisation des médicaments, ainsi que la recherche de nouvelles pistes dans d'autres candidats médicaments potentiels, ", a déclaré l'auteur correspondant de l'ORNL, Leighton Coates. "Nos données de température ambiante sont utilisées pour créer un modèle plus précis pour ces simulations et améliorer les activités de conception de médicaments."
La prochaine étape des chercheurs pour compléter le modèle 3D de la protéase principale du SRAS-CoV-2 consiste à utiliser la diffusion des neutrons au réacteur à isotope à haut flux de l'ORNL et à la source de neutrons de spallation. Les neutrons sont essentiels pour localiser les atomes d'hydrogène, qui jouent un rôle essentiel dans de nombreuses fonctions catalytiques et efforts de conception de médicaments.
L'ADN plasmidique de protéase utilisé pour fabriquer l'enzyme a été fourni par le centre de biologie structurale d'Argonne à la source avancée de photons. La cristallisation des protéines utilisées dans les expériences de diffusion des rayons X a été réalisée au Centre de biologie structurale et moléculaire de l'ORNL.