
Vue dans la chambre à ultravide (échantillon de catalyseur au milieu). Crédit :Université de technologie de Vienne
En chimie, les atomes ne peuvent généralement affecter que leur voisinage immédiat. A la TU Vienne, un nouvel effet avec une action à longue portée étonnante a été découvert, ce qui peut rendre les convertisseurs catalytiques automobiles plus efficaces.
Le goût du glaçage du gâteau au chocolat ne doit pas dépendre du fait qu'il soit servi sur une assiette en porcelaine ou en argent. De la même manière, pour les réactions chimiques à la surface de gros grains de métaux précieux, le substrat (le soi-disant support) ne doit pas jouer un rôle crucial. Les grains catalytiques ont souvent un diamètre couvrant plusieurs milliers d'atomes, et le support sur lequel ils reposent ne devrait donc pas affecter les réactions chimiques de l'autre côté loin de l'interface, du moins on le croyait jusqu'à présent.
Des études expérimentales menées à TU Wien ont conduit à des résultats surprenants. Procédés chimiques sur les grains de palladium, qui sont également utilisés pour les catalyseurs de gaz d'échappement, changé de manière significative lorsqu'ils ont été placés sur des matériaux de support spécifiques, malgré le fait que le matériau du support est presque inactif dans la réaction chimique elle-même. Ce nouvel aperçu a maintenant été publié dans la revue Matériaux naturels .
Monoxyde de carbone toxique
Pour les véhicules utilisant un moteur à combustion interne, le monoxyde de carbone (CO) toxique doit être converti en dioxyde de carbone (CO2). Ceci est réalisé en utilisant des catalyseurs contenant de la poudre de palladium ou de platine. "Nous avons étudié des réactions chimiques sur des grains de poudre, souvent utilisées en catalyse industrielle, " explique le professeur Günther Rupprechter de l'Institut de chimie des matériaux de la TU Wien. " Les grains de métal précieux ont un diamètre de l'ordre de 100 micromètres, ce qui est très grand selon les normes de la nanotechnologie, on peut presque les voir à l'œil nu".
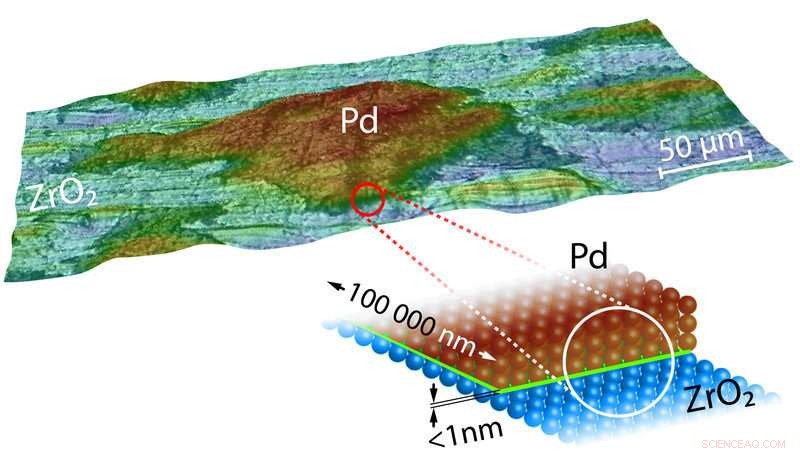
Image 3-D et un dessin modèle d'un Pd-ZrO
Lorsque la surface des particules de poudre est recouverte d'atomes d'oxygène, Les molécules de CO réagissent avec elles et se transforment en CO2, laissant des sites vides (trous) dans la couche d'oxygène. Ces sites doivent être rapidement remplis par d'autres atomes d'oxygène pour soutenir la catalyse. Cependant, ce n'est plus le cas lorsque des molécules de CO remplissent ces trous à la place de l'oxygène. Si cela se produit à grande échelle, la surface du catalyseur n'est plus recouverte d'une couche d'oxygène mais d'une couche de CO, et le CO2 ne peut donc plus se former. Ce phénomène est appelé « intoxication au monoxyde de carbone », il désactive le catalyseur.
Le support influence tout le grain
Que cela se produise ou non dépend de la concentration de CO dans les gaz d'échappement fournis au catalyseur. Cependant, comme le montrent les expériences en cours, le matériau support sur lequel sont placés les grains de palladium est également déterminant. "Si les grains de Palladium sont placés sur une surface d'oxyde de zirconium ou d'oxyde de magnésium, puis l'empoisonnement du catalyseur se produit à des concentrations de monoxyde de carbone beaucoup plus élevées, " dit le professeur Yuri Suchorski, le premier auteur de l'étude. A première vue, c'est très surprenant pour de si gros grains de palladium. Pourquoi la nature du support devrait-elle avoir un effet sur les réactions chimiques qui se déroulent à la surface de l'ensemble du grain métallique ? Pourquoi la ligne de contact entre le grain de palladium et le substrat, qui ne fait que quelques dixièmes de nanomètre de large, influencer le comportement de grains de palladium cent mille fois plus gros ?
Ce casse-tête a enfin pu être résolu à l'aide du microscope électronique à photoémission spécial de l'Institut de chimie des matériaux de la TU Wien. Avec cet appareil, la propagation spatiale d'une réaction catalytique peut être suivie en temps réel. "Nous pouvons clairement observer que l'intoxication au monoxyde de carbone commence toujours au bord d'un grain, exactement là où il entre en contact avec le support, " explique le Pr Yuri Suchorski. " A partir de là, « l'empoisonnement au monoxyde de carbone » se propage comme une vague de tsunami sur le grain entier. »

Vue dans la chambre à ultravide (échantillon de catalyseur au milieu) et image PEEM « in situ » d'un front de réaction de CO. Crédit :Université de technologie de Vienne
Le monoxyde de carbone attaque mieux à la frontière
C'est principalement pour des raisons géométriques que l'onde d'empoisonnement commence exactement là :les atomes d'oxygène au bord du grain ont moins d'atomes d'oxygène voisins que ceux de la surface intérieure. Lorsque des sites gratuits s'ouvriront là-bas, il est donc plus facile pour une molécule de CO de peupler ces sites que ces sites quelque part au milieu de la surface libre, où CO réagirait facilement avec d'autres atomes d'O tout autour. En outre, il n'est pas facile pour d'autres atomes d'oxygène de remplir les zones vacantes à la frontière, puisque les atomes d'oxygène viennent toujours par paires, sous forme de molécules d'O2. Par conséquent, remplir un site vide, O2 a besoin de deux sites libres l'un à côté de l'autre, et il n'y a pas beaucoup de place pour cela à la frontière.
La limite où le grain de palladium est en contact direct avec le support est donc d'une grande importance stratégique - et c'est précisément à cette interface que le support est capable d'influencer les propriétés du grain métallique :"Les calculs de nos partenaires de coopération de l'Université de Barcelone montrent que la liaison entre les atomes métalliques du grain et la couche d'oxygène protectrice est renforcée précisément à la limite du support, " explique le Prof. Günther Rupprechter. Les atomes de palladium en contact intime avec le support oxyde peuvent ainsi lier l'oxygène plus fort.
On peut supposer que cela n'a pas d'importance pour les sites métalliques éloignés du bord du grain, car le support ne peut influencer énergétiquement que les atomes à la frontière - et ceux-ci ne sont que très peu nombreux, par rapport au nombre total d'atomes dans le grain de palladium. Cependant, parce que l'intoxication au monoxyde de carbone commence à la frontière, cet effet est d'une grande importance stratégique. La frontière métal-oxyde est en fait le "point faible" du grain - et si ce point faible est renforcé (les propriétés catalytiques des atomes métalliques à la frontière sont positivement affectées par le support), l'ensemble du grain de catalyseur de taille micrométrique est protégé contre l'empoisonnement au monoxyde de carbone.
« Divers supports oxydes sont déjà utilisés dans les catalyseurs, mais leur rôle exact lors de la catalyse en termes d'empoisonnement au CO n'a pas encore été directement observé" explique le professeur Günther Rupprechter. "Avec nos méthodes, le processus en cours et son effet ondulatoire à longue portée ont été directement visualisés pour la première fois, et cela ouvre de nouvelles voies prometteuses vers les catalyseurs améliorés du futur".