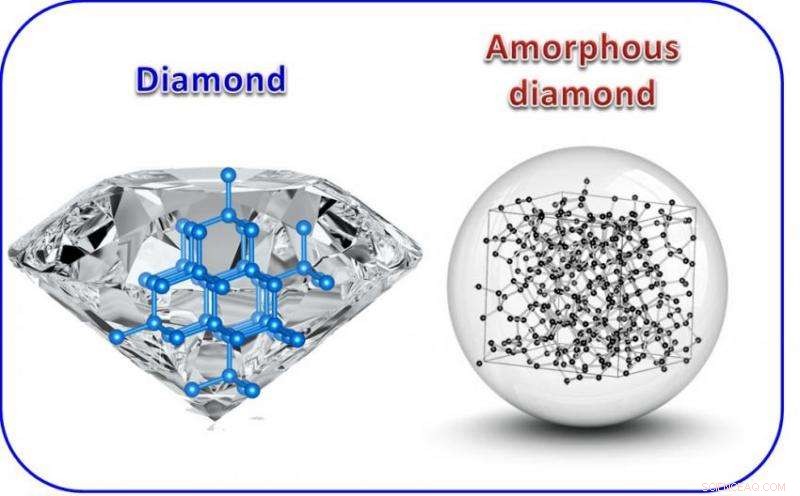
Structure atomique du diamant (à gauche) comparée au diamant amorphe (à droite). Le diamant est cristallin et anisotrope, ce qui signifie que ses propriétés sont directionnelles. Le diamant monocristallin montré sur la photo de gauche contient de nombreuses facettes. En revanche, le diamant amorphe est isotrope comme le verre, et il peut être coupé à n'importe quelle forme, y compris une sphère idéale. Crédit :Zhidan « Denise » Zeng
Une équipe de physiciens des hautes pressions de Carnegie a créé une forme de carbone aussi dure que le diamant, mais amorphe, ce qui signifie qu'il manque la répétition structurelle à grande échelle de la structure cristalline d'un diamant. Leurs conclusions sont rapportées dans Communication Nature .
Le carbone est un élément aux possibilités apparemment infinies, car la configuration de ses électrons permet de nombreuses combinaisons d'auto-liaison qui donnent naissance à une gamme de matériaux aux propriétés variables.
Par exemple, certaines formes de carbone, comme le charbon, sont ce qu'on appelle amorphes, ce qui signifie qu'ils n'ont pas la structure répétitive à longue portée qui constitue un cristal.
D'autres formes de carbone sont cristallines, y compris à la fois transparent, diamants extra-durs, et doux, graphite opaque. Ils ont des propriétés différentes, en partie, car les atomes de carbone qui les composent sont liés dans des configurations différentes. Les diamants ont une structure de liaison appelée sp3 et le carbone du graphite est maintenu par ce qu'on appelle des liaisons sp2.
Les modifications de la configuration des liaisons carbone qui façonnent l'une de ces substances peuvent être induites en modifiant les conditions externes, comme la température et la pression, semblable à la façon dont l'eau gèle en glace ou bout en vapeur.
L'équipe Carnegie, dont l'auteur principal Zhidan "Denise" Zeng, ainsi que Liuxiang Yang, Qiaoshi Zeng, Yue Meng, Wengé Yang, et Ho-kwang "Dave" Mao - ont utilisé des pressions extrêmes pour découvrir leur nouvelle forme de diamant amorphe.
D'autres éléments similaires au carbone - le germanium et le silicium - ont des formes entièrement composées de liaisons sp3 extrêmement fortes et pourtant amorphes. Mais jusqu'à maintenant, une phase similaire de carbone n'avait jamais été synthétisée.
L'équipe a réussi à créer un diamant amorphe en amenant une forme de carbone structurellement désordonnée appelée carbone vitreux jusqu'à près de 500, 000 fois la pression atmosphérique normale (50 gigapascals) et environ 2, 780 degrés Fahrenheit (1, 800 degrés Kelvin). Il s'agit d'une plage de température et de pression qui n'a pas été explorée dans les efforts visant à créer un diamant amorphe.
L'échantillon qu'ils ont créé a conservé son changement structurel et son incompressibilité une fois revenu à la température et à la pression ambiantes. Quoi de plus, des outils de spectroscopie sophistiqués ont démontré que leur nouveau matériau présente des liaisons carbone sp3, en dépit d'être amorphe et dépourvu de l'ordre d'un cristal.
"Notre diamant amorphe est dense, transparent, super fort et potentiellement super dur avec des propriétés plus incroyables encore à découvrir, " expliqua Zeng.
Les prochaines étapes de la recherche des propriétés de ce diamant amorphe seront de mesurer sa dureté, force, propriétés optiques, et la stabilité thermique.