Un western blot permet aux scientifiques de détecter des protéines spécifiques dans des échantillons de tissus. Crédit :www.shutterstock.com
La journaliste scientifique Maryanne Demasi a été innocentée le mois dernier des allégations d'inconduite en matière de recherche concernant son doctorat à l'Université d'Adélaïde. Thèse publiée en 2004.
Les allégations ont fait l'objet d'une enquête par un panel indépendant convoqué par le Bureau d'éthique de la recherche de l'Université d'Adélaïde, Conformité et intégrité. Il comprenait un ancien juge de la Cour suprême d'Australie-Méridionale et trois professeurs de sciences médicales non liés à l'Université d'Adélaïde.
Il y avait 17 allégations concernant des images dans la thèse de Demasi. La question posée au panel était de savoir si les images "avaient été dupliquées et/ou manipulées d'une manière qui s'écartait des normes applicables au moment pertinent".
Toutes les images contestées représentaient les résultats d'expériences visant à détecter des protéines ou des molécules d'ARN. Les techniques pour ce faire sont connues sous le nom de "western blot" et "northern blot", respectivement.
Dans 14 cas, le panel a constaté qu'aucune duplication d'image n'avait eu lieu. Dans les trois cas restants, Demasi "a admis qu'elle avait dupliqué ou probablement dupliqué les images contestées pertinentes" - mais le panel "n'a pas pu être convaincu que la duplication constituait un écart par rapport aux normes applicables au moment pertinent".
Il n'est pas clair si les images de transfert sont au centre de la Journal de chimie biologique l'expression de préoccupation de 2017 concernant l'un des articles scientifiques de Demasi publié en 2003.
Demasi nie fermement toute faute de recherche dans sa thèse et ses articles de recherche. Mais que sont les blots ouest et nord ? Et pourquoi attirent-ils un tel examen ?
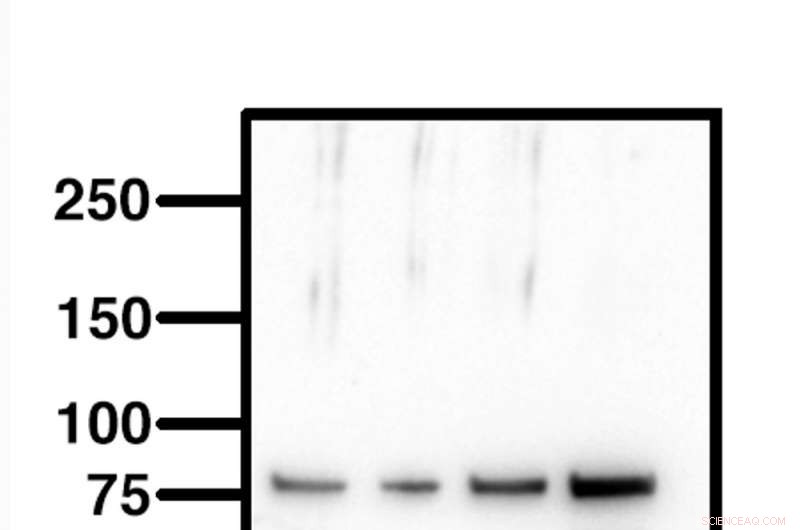
Un bon western blot montrera toute la membrane, de 250 kilodaltons à 10 kilodaltons, et être propre à l'exception de la protéine d'intérêt. Chaque bande représente un échantillon différent et doit donc être visuellement différente. Crédit :Western blot de l'auteur
Détecter les protéines
Les westerns blots détectent les protéines, et sont une technique scientifique couramment utilisée et sensible. L'image qu'ils produisent peut ressembler à une tache indescriptible, mais les western blots sont en fait un moyen très utile de se concentrer sur une protéine spécifique dans un mélange complexe de matériaux biologiques, comme du sang ou des tissus.
Les Western blots sont utilisés dans le diagnostic de la maladie de Lyme, par exemple. C'est parce que l'infection par la bactérie qui cause la maladie de Lyme ( Borrelia burgdorferi ) laisse une empreinte unique de protéines dans le sang d'un patient.
Les Western blots permettent également aux chercheurs de déterminer les changements dans les protéines en réponse à un régime médicamenteux. Dans mon propre laboratoire, J'exécute régulièrement des westerns blots pour mesurer les changements dans les profils protéiques en réponse à un complément alimentaire que nous testons pour le traitement de la maladie des motoneurones.
Occidental, du sud, nord
Les Western blots portent le nom de l'emplacement du laboratoire américain où ils ont été effectués pour la première fois. Le choix du terme "western" est apparemment en hommage aux blots précédemment nommés Southern (du nom d'Ed Southern) et Northern, pour détecter l'ADN et l'ARN, respectivement.
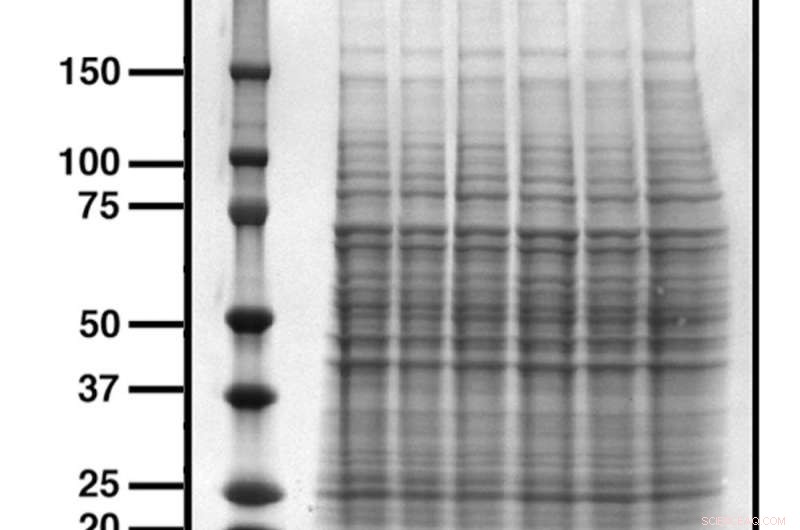
Un mélange de protéines est d'abord séparé par leur poids moléculaire, avec les petits se déplaçant plus vite et atteignant le fond du gel plus tôt, pour créer une apparence semblable à une échelle. Une coloration protéique permet de visualiser les protéines, où chaque bande représente une population différente de protéines. Crédit :propre coloration de protéine de l'auteur
Pour exécuter un western blot, un mélange de protéines est chargé sur un gel de polyacrylamide qui permet la séparation des protéines en fonction de leurs poids moléculaires. Le poids moléculaire est mesuré en kilodaltons, ou kDa (le dalton ou unité de masse atomique est défini comme 1/12 du poids de l'isotope du carbone 12, ou environ un atome d'hydrogène).
Lorsqu'un courant électrique est appliqué, les petites protéines se déplacent relativement rapidement à travers le gel, et les plus gros plus lentement - le résultat est une distribution en échelle des protéines.
Après ça, l'échelle protéique est immergée dans une solution d'anticorps et incubée. Lorsque l'excès d'anticorps est éliminé, vous vous retrouvez avec une "bande" où votre anticorps s'est lié à votre protéine d'intérêt.
Ce qu'il faut chercher
Parce qu'un western blot est conçu pour détecter une protéine à la fois, l'image doit être vide, à l'exception de votre bande d'intérêt.
Vous trouverez ci-dessous un mauvais western blot que j'ai préparé plus tôt. A présent, vous devriez être capable d'identifier ce qui ne va pas avec celui-ci - il a plusieurs bandes, ce qui signifie que l'anticorps n'est pas spécifique. Et bien qu'il soit tentant de supprimer des bandes supplémentaires et des artefacts superflus, Je devrais vraiment retourner au labo pour optimiser ça.
Surtout, chaque échantillon passé sur un western blot est unique, Ainsi, chaque bande d'échantillon doit également être différente.
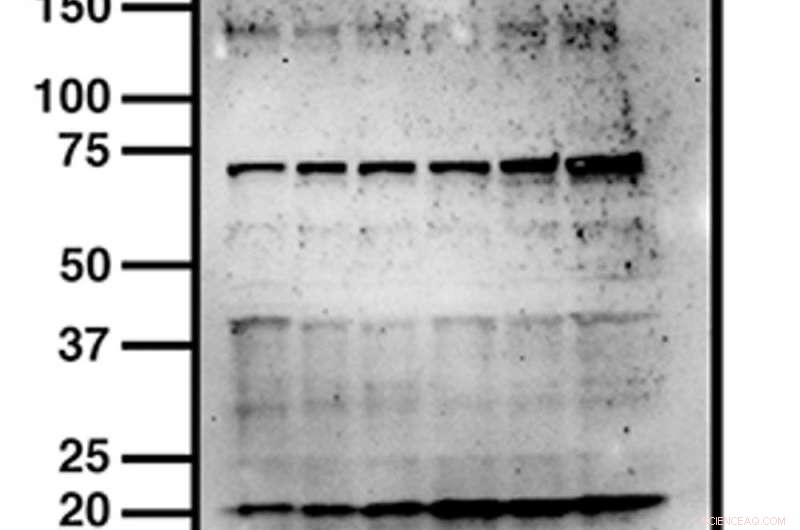
Un bad western blot a plusieurs bandes au lieu d'une, ce qui signifie que l'anticorps a reconnu plusieurs protéines et n'est donc pas spécifique. Il n'est pas rare que les scientifiques recadrent étroitement ces images pour supprimer les artefacts incriminés. Par conséquent, certaines revues demandent maintenant aux auteurs de soumettre l'intégralité, image non recadrée, pour évaluation. Crédit :propre bad western de l'auteur
Un Northern blot est un concept similaire au western blot, mais utilise couramment des sondes pour détecter l'ARN au lieu de celles pour détecter les protéines. Dans la technique du Southern blot, L'ADN est détecté.
Surveillance accrue
Depuis l'avènement de sites Web tels que PubPeer, Les western blots sont de plus en plus scrutés. Le blog indépendant Retraction Watch cite des dizaines d'articles qui auraient été rétractés pour manipulation de western blot.
Les Western blots peuvent être manipulés de plusieurs manières - en dupliquant des bandes de protéines, ou par retournement vertical ou horizontal pour rendre les bandes réutilisées uniques. La duplication est généralement effectuée à l'aide d'un logiciel de manipulation d'images, où il est plus facile à dissimuler.
La manipulation peut être détectée en recherchant des artefacts tels que des épissures évidentes, formes de bande similaires, ou des taches et des rayures qui se prolongent sur les bandes dupliquées.
Mais manipuler des images n'aide personne. Les scientifiques subissent une pression intense pour publier ou périr, où les publications scientifiques sont de plus en plus traitées comme une monnaie à échanger contre des promotions ou des titularisations.
Manipuler les images ne fait que contribuer à une méfiance envers la science, à un moment où nous devons de plus en plus la défendre.
Cet article a été initialement publié sur The Conversation. Lire l'article original. 