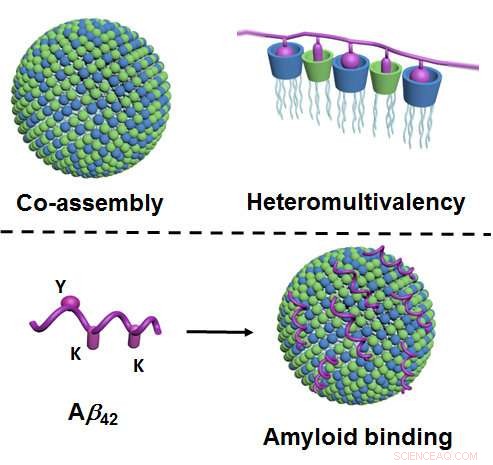
Haut de la figure :Par co-assemblage, deux composants de type lipidique forment des nanoparticules dans l'eau qui ont un très grand nombre de points de contact différents (représentés en bleu et vert; à gauche). En raison de nombreux points de contact différents interagissant simultanément avec la protéine (indiqués en violet), un degré de sélectivité particulièrement élevé se produit ("hétéromultivalence", droit). En bas de la figure :Via leurs points de contact (vert et bleu), les nanoparticules se lient aux amyloïdes - ici, Plus précisément, bêta-amyloïde 42 (violet), et ainsi empêcher leur agrégation. La liaison s'effectue via les points de contact correspondants sur l'amyloïde ("Y" et "K"; à gauche). Crédit :Université de Münster - Bart Jan Ravoo
Une nouvelle méthode de liaison sélective de protéines à des nanoparticules a été décrite par une équipe de chercheurs allemands et chinois dirigée par le professeur Bart Jan Ravoo, chimiste à l'Université de Münster (Allemagne). Les nanoparticules reconnaissent automatiquement des peptides spécifiques, c'est-à-dire de petites protéines, et conclure avec eux une liaison hautement sélective. Parmi les peptides modèles que les chercheurs ont examinés, il y avait des amyloïdes. Les dépôts d'amyloïdes jouent un rôle majeur dans la maladie d'Alzheimer, par exemple, les chercheurs espèrent donc que le mécanisme qu'ils ont découvert pourrait fournir une nouvelle approche pour traiter les maladies dans lesquelles de tels dépôts se produisent. L'étude a été publiée dans le dernier numéro de Chimie de la Nature.
L'interaction entre des molécules protéiques ou entre elles et d'autres biomolécules joue un rôle majeur dans de très nombreux processus physiologiques. Dans ce contexte, la reconnaissance moléculaire implique la liaison de protéines à travers de multiples points de contact à l'échelle nanométrique à la surface de la protéine. Typiquement, un très grand nombre de ces points sont concernés, résultant en un unique, surface de contact exacte et complémentaire. Le mécanisme de liaison de ces molécules protéiques est donc décrit comme un "principe clé et verrou". Les chercheurs ont maintenant décrit une méthode pour produire de telles surfaces de contact sur des nanoparticules afin que des protéines sélectionnées puissent être ciblées et liées.
Co-assemblage et « hétéromultivalence »
La nouveauté de la méthode est qu'elle repose sur les principes de co-assemblage et d'hétéromultivalence. Le co-assemblage signifie que les nanoparticules ne sont pas, comme c'est habituellement le cas, produites à la suite d'une synthèse chimique complexe et sur mesure. Au lieu, les chercheurs les produisent selon une méthode relativement simple dans laquelle deux composants de type lipidique ("gras") sont mélangés dans de l'eau et forment spontanément les nanoparticules requises. Ces particules sont adaptatives, c'est-à-dire qu'ils modifient leur structure interne et obtiennent ainsi une liaison optimale à la protéine cible. « Hétéromultivalence » signifie que les nanoparticules forment un très grand nombre de points de contact différents qui, à la fois, interagir avec la protéine. A l'instar des processus physiologiques naturels, il se produit ainsi une sélectivité particulièrement élevée.
"Jusque là, ce principe d'hétéromultivalence en particulier n'a guère été examiné en détail ou exploité, " explique Bart Jan Ravoo. " Nous décrivons une approche entièrement nouvelle qui permettra de développer d'autres liants protéiques synthétiques. Cela pourrait être envisagé pour une utilisation dans le diagnostic ou l'imagerie, ou en tant qu'ingrédients actifs potentiels dans les médicaments. » Les chercheurs ont montré que les nanoparticules se lient aux amyloïdes et, par conséquent, dissoudre les agrégats de ces peptides. L'apparition d'agrégats amyloïdes est étroitement liée au développement de la maladie d'Alzheimer. C'est pourquoi la nouvelle méthode pourrait fournir une approche pour développer de nouveaux types de traitement. Il n'a pas encore été clarifié, cependant, si les agrégats amyloïdes causent effectivement la maladie d'Alzheimer ou sont, plutôt, une conséquence de la maladie. De plus, la nouvelle méthode de dissolution des agrégats n'a été expérimentée qu'en éprouvette. Des études complémentaires sont donc nécessaires afin d'évaluer plus clairement son potentiel en tant qu'approche thérapeutique.
La méthode
Les chercheurs ont utilisé des amphiphiles, molécules hydrosolubles de cyclodextrine et de calixarène en tant que composants de co-assemblage pour les points de nano-contact. Ils ont examiné la liaison des nanoparticules résultantes aux peptides, en utilisant par exemple la spectroscopie de fluorescence. Ils ont utilisé la microscopie électronique pour démontrer la liaison aux amyloïdes.