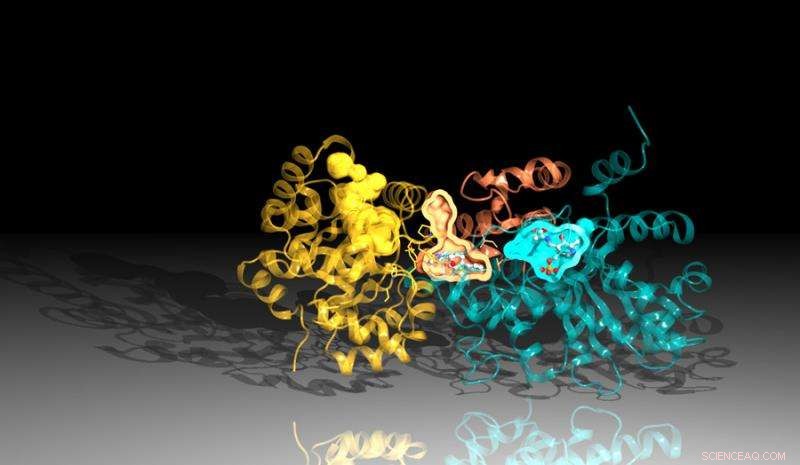
Image de la protéine tryptophane synthase créée à l'aide des données de diffraction de la source avancée de photons d'Argonne. L'inhibiteur se lie entre les sites de réaction dans la protéine, représenté ici par les poches orange et bleue. Crédit :Laboratoire National d'Argonne
La tuberculose a désormais dépassé le VIH dans le monde en tant que principale cause de décès dus aux maladies infectieuses. La bactérie qui cause cette maladie, Mycobacterium tuberculosis (Mtb), développe rapidement une résistance aux antibiotiques actuellement disponibles, accroître l'urgence de la découverte de nouveaux médicaments.
Des scientifiques du laboratoire national d'Argonne du département américain de l'Énergie (DOE) ont participé à une récente découverte d'une nouvelle molécule appelée inhibiteur qui attaque les bactéries responsables de la tuberculose en coupant sa production d'un produit chimique nécessaire à sa survie.
La création d'antibiotiques implique le développement d'inhibiteurs capables de bloquer efficacement les processus bactériens essentiels. Il est tout aussi important de continuer à trouver de nouvelles voies à cibler afin que lorsque les bactéries s'adaptent finalement pour résister à un antibiotique, il existe encore d'autres pistes à exploiter.
La nouvelle étude, une collaboration entre Argonne, l'Université de Chicago et le Broad Institute of Harvard et MIT, identifié un inhibiteur qui fonctionne en bloquant l'action d'une protéine importante dans Mtb. L'inhibiteur se lie à un canal dans la protéine qui relie ses deux parties, tuer les bactéries par une torsion ironique. L'inhibiteur force une partie de la protéine à produire les composants nécessaires pour créer un produit chimique essentiel, tryptophane, tout en remodelant le canal pour intercepter ces ingrédients avant que l'autre partie de la protéine ne puisse les utiliser.
Ces types d'inhibiteurs, appelés inhibiteurs allostériques, ne se lient pas à la partie de la protéine réellement responsable de la production du produit chimique cible. Au lieu, ils agissent comme une clé à molette coincée dans d'autres parties moins évidentes de la machinerie compliquée des bactéries. L'inhibiteur identifié dans cette recherche, décrit dans un article récent dans Nature Chemical Biology, est maintenant l'un des inhibiteurs allostériques les plus étudiés à ce jour.
Le produit chimique ciblé, tryptophane, est une substance cruciale pour donner à toutes les cellules vivantes leur structure et les protéger de leur environnement. Les cellules humaines doivent fouiller le tryptophane dans les aliments ou les bactéries dans l'intestin, mais les cellules Mtb peuvent fabriquer leur propre tryptophane en utilisant une protéine complexe appelée tryptophane synthase. "Nous savions qu'un moyen de tuer ces bactéries était de trouver un moyen de bloquer la tryptophane synthase, " a déclaré Karolina Michalska, cristallographe d'Argonne et auteur de l'étude.
Avant le début de la collaboration, un groupe de scientifiques du Broad Institute a mis une petite quantité de bactéries dans des boîtes de Pétri et placé différents inhibiteurs potentiels dans chacune. Sur une bibliothèque de plus de 80, 000 inhibiteurs potentiels testés, seuls quelques-uns ont tué le VTT. Les scientifiques soupçonnaient que l'un de ces inhibiteurs arrêtait la tryptophane synthase du Mtb, mais ils avaient besoin de voir ce qui se passait au niveau moléculaire.
Les scientifiques d'Argonne ont entendu parler des travaux du Broad Institute, et les deux groupes ont commencé à collaborer. Argonne a produit de la tryptophane synthase pour que le Broad Institute l'utilise pour tester l'inhibiteur. Ils ont également déterminé la structure de la synthase avec l'inhibiteur qui lui est lié en exposant des cristaux composés du complexe protéine-inhibiteur aux rayons X à haute énergie de la source de photons avancée (APS) d'Argonne et en enregistrant comment les électrons de la molécule ont diffusé la lumière. .
"La collaboration nous a permis de déterminer la nature allostérique de l'inhibiteur et les nuances de son fonctionnement, " a déclaré Deborah Hung, professeur à la Harvard Medical School et codirecteur du programme Infectious Disease and Microbiome au Broad Institute.
L'analyse structurelle a déterminé qu'il y a deux parties clés qui composent la tryptophane synthase. Lorsqu'une des régions signale à l'autre qu'elle est prête, l'autre région fabrique une substance chimique appelée indole. L'indole se déplace ensuite à travers un canal vers l'autre région de la tryptophane synthase où il se combine avec une autre substance pour créer le produit final, tryptophane.
Une légère instabilité dans le canal permettrait à l'indole de passer de l'autre côté, mais l'inhibiteur est façonné de manière à stabiliser le canal, empêchant l'indole de bouger. Étant donné que l'indole ne peut pas atteindre l'autre côté de la protéine, l'inhibiteur bloque la production de tryptophane.
"Cela fonctionne en fait d'une manière assez sournoise, " a déclaré Andrzej Joachimiak, Directeur du Centre de biologie structurale d'Argonne et du Centre de génomique structurale du Midwest. "L'inhibiteur force à la fois la tryptophane synthase à produire l'indole et l'empêche d'accomplir son devoir ultime."
Bien que les chercheurs soient optimistes quant au potentiel de cet inhibiteur en tant qu'antibiotique, il est encore loin d'être un produit pharmaceutique disponible. Ils ont étudié comment les tissus humains réagiraient à la molécule et ont confirmé qu'elle est non toxique, mais des expériences chez la souris ont montré que l'inhibiteur serait métabolisé par l'organisme trop rapidement. Des recherches sont actuellement en cours pour affiner la structure de l'inhibiteur afin qu'il persiste dans la circulation sanguine pendant une période de temps prolongée.