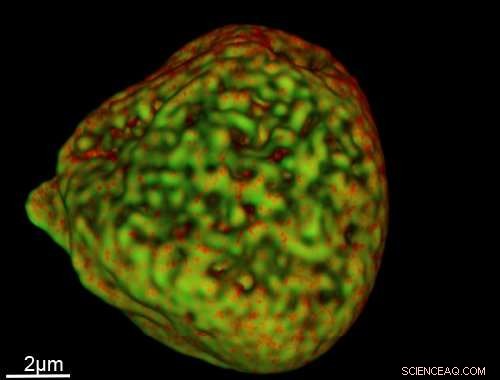
Une image d'un noyau cellulaire capturée à l'aide de la nouvelle sonde. Crédit :Université de Sheffield
Les scientifiques ont développé une nouvelle technique pour capturer des images du noyau d'une cellule avec des détails sans précédent, ouvrant la voie à de nouvelles connaissances sur les maladies humaines et le vieillissement.
En utilisant une nouvelle sonde luminescente pour éclairer les composants de la cellule, des chercheurs du département de chimie de l'Université de Sheffield ont capturé des images 3D saisissantes d'ADN dans les noyaux à des échelles inférieures à 40 nanomètres (un nanomètre =un milliardième de mètre).
Les propriétés uniques de la sonde la rendent mieux adaptée à une utilisation en microscopie à super-résolution que les sondes existantes, qui ne sont pas suffisamment stables pour subir de longues périodes d'irradiation sous une lumière intense que nécessite cette branche de la microscopie.
Sree Sreedharan, un doctorant au département de chimie, développé la sonde basée sur le Ruthénium chimique, en collaboration avec le Rutherford Appleton Laboratory d'Oxford et des chercheurs des départements des sciences biomédicales de Sheffield, et Physique et Astronomie.
Son superviseur, Le professeur Jim Thomas a déclaré : « , très détaillé, Structures 3D montrant l'ADN disposé dans le noyau.
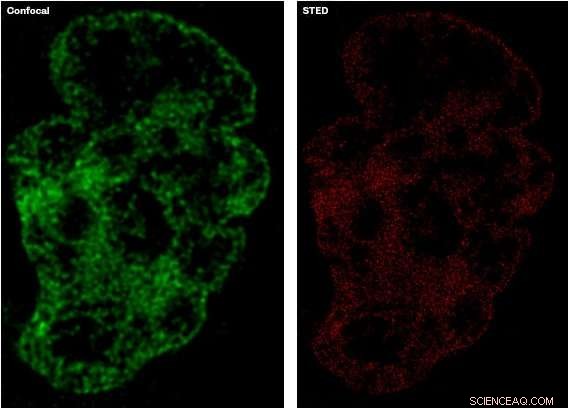
L'image de gauche, en vert, montre le niveau de détail capturé à l'aide de techniques de microscopie confocale établies, par rapport à l'image de droite, en rouge, qui montre une image plus détaillée capturée à l'aide de la microscopie STED. Crédit :Université de Sheffield
"Comme l'ADN fournit les plans de la vie, des études de super-résolution permettront de comprendre comment il est stocké, lire, et traité. De telles études fourniront de nouvelles informations sur le développement de maladies telles que le cancer et peut-être même sur les processus cellulaires impliqués dans le vieillissement."
En étudiant le fonctionnement des cellules saines et ce qui se passe lorsqu'elles fonctionnent mal, les chercheurs peuvent approfondir leur compréhension du fonctionnement de la vie à son niveau le plus fondamental, et développer de nouveaux médicaments et traitements pour les maladies.
Cependant, les cellules sont microscopiques, transparent, et le plus souvent incolore. Pour les voir au microscope, les scientifiques utilisent des sondes luminescentes qui se lient aux composants cellulaires et les « éclairent ». Bien que cette approche ait énormément avancé notre compréhension de la fonction cellulaire, toutes les caractéristiques inférieures à environ 300 nanomètres ne peuvent pas être distinguées par les microscopes normaux basés sur la lumière.
Des microscopes à super-résolution ont été développés au cours de la dernière décennie, qui peut, dans les bonnes circonstances, fonctionner à des échelles beaucoup plus petites. Eric Betzig, Stefan W. Hell et William E. Moerner ont reçu le prix Nobel de chimie en 2014 pour leurs travaux dans ce domaine.
Le défi pour les chimistes est de développer de nouvelles sondes avec des propriétés optiques qui répondent aux exigences que ces techniques avancées leur imposent - par exemple, La microscopie STED (déplétion par émission stimulée) nécessite des sondes exceptionnellement stables photochimiquement.
La nouvelle sonde à base de ruthénium a été développée pour être utilisée dans la microscopie électronique à transmission à balayage (STEM) et les résultats ont été publiés en ligne dans le Journal de l'American Chemical Society . La recherche a été réalisée dans le cadre du projet Imagine:Imaging Life de l'Université de Sheffield, qui utilise des techniques de microscopie révolutionnaires pour répondre à certaines des plus grandes questions de la biologie et de la médecine.