
Micrographie électronique de l'échafaudage « vide » (sans hydrogel) utilisé par une équipe de recherche internationale pour déformer des cellules individuelles. Crédit :Marc Hippler, TROUSSE
Le comportement des cellules est contrôlé par leur environnement. Outre des facteurs biologiques ou des substances chimiques, des forces physiques telles que la pression ou la tension sont également impliquées. Des chercheurs de l'Institut de technologie de Karlsruhe (KIT) et de l'Université de Heidelberg ont développé une méthode qui leur permet d'analyser l'influence des forces externes sur des cellules individuelles. En utilisant un procédé d'impression 3D, ils ont produit des micro-échafaudages, dont chacun a quatre piliers sur lesquels une cellule est située. Déclenché par un signal externe, un hydrogel à l'intérieur de l'échafaudage gonfle et écarte les piliers, de sorte que la cellule doit "s'étirer". Le travail fait partie du Pôle d'Excellence "Matière 3D sur commande" (3DMM2O). Les chercheurs rendent compte de leurs résultats dans Avancées scientifiques .
De nombreux processus biologiques cellulaires, comme la cicatrisation des plaies ou le développement des tissus, sont fortement influencés par les propriétés de leur environnement. Les cellules réagissent, par exemple, à des facteurs biologiques ou à des substances chimiques. Cependant, la recherche se concentre de plus en plus sur les forces physiques agissant sur les cellules :comment les cellules s'adaptent-elles exactement à ces forces ?
Dans le cadre du Consortium universitaire germano-japonais HeKKSaGOn et en coopération avec des scientifiques australiens, l'équipe 3DMM2O a abordé cette question avec une approche particulièrement ingénieuse. Pour la fabrication de leurs « racks d'étirage » cellulaires, ils ont utilisé « l'écriture laser directe, " un processus d'impression 3D spécial dans lequel un faisceau laser contrôlé par ordinateur est concentré dans un liquide d'encre d'imprimante spécial. Ses molécules ne réagissent qu'aux zones exposées et y forment un matériau solide. Toutes les autres zones restent liquides et peuvent être éliminées par lavage "Il s'agit d'une méthode établie dans notre pôle d'excellence pour la construction de structures tridimensionnelles à l'échelle micrométrique et inférieure, " explique Marc Hippler du KIT Institute of Applied Physics, auteur principal de la publication.
Dans le cas actuel, les chercheurs ont utilisé trois encres d'imprimante différentes :la première encre, fait de matériau répulsif aux protéines, a été utilisé pour former le véritable micro-échafaudage. En utilisant une deuxième encre de matériau attirant les protéines, ils ont ensuite produit quatre barres horizontales qui sont reliées chacune à l'un des piliers de l'échafaudage. La cellule est ancrée à ces quatre barres. Le vrai écueil, cependant, est la troisième encre :les scientifiques l'ont utilisée pour "imprimer" une masse à l'intérieur de l'échafaudage. S'ils ajoutent ensuite un liquide spécial, l'hydrogel gonfle. Il développe ainsi une force suffisante pour déplacer les piliers - et les barreaux avec eux. Cette, à son tour, a pour effet d'étirer la cellule qui est fixée aux barreaux.
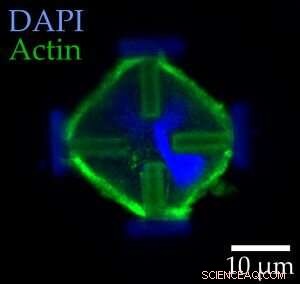
Images au microscope optique de cellules de souris embryonnaires colorées dans leurs états normaux (à gauche) et étirés (à droite). Les flèches rouges indiquent les forces agissant sur les cellules. Crédit :Marc Hippler
Les cellules neutralisent la déformation
Les scientifiques du Pôle d'Excellence ont placé deux types de cellules complètement différents sur leur micro-support d'étirement :des cellules tumorales osseuses humaines et des cellules embryonnaires de souris. Ils ont découvert que les cellules contrecarraient les forces externes avec des protéines motrices et augmentaient ainsi considérablement leurs forces de traction. Lorsque la force d'étirement externe est supprimée, les cellules se détendent et reviennent à leur état d'origine. "Ce comportement est une démonstration impressionnante de la capacité d'adaptation à un environnement dynamique. Si les cellules étaient incapables de récupérer, ils ne rempliraient plus leur fonction d'origine - par exemple la fermeture des plaies, " explique le professeur Martin Bastmeyer de l'Institut zoologique du KIT.
Comme l'équipe l'a découvert, une protéine appelée NM2A (non musculaire myosine 2A) joue un rôle décisif dans la réponse des cellules à la stimulation mécanique :les cellules tumorales osseuses génétiquement modifiées qui ne peuvent pas produire de NM2A ont à peine pu contrer la déformation externe.
Les travaux du pôle d'excellence ont été réalisés par des scientifiques de Heidelberg issus du domaine de la chimie biophysique ainsi que de la physique et de la neurobiologie cellulaire et cellulaire du KIT. Les membres du Consortium universitaire germano-japonais HeKKSaGOn comprennent, entre autres, Université de Heidelberg, Institut de technologie de Karlsruhe et Université d'Osaka.