L'interférence ARN (ARNi) est un processus biologique fascinant chez les vers, les plantes, les champignons et les métazoaires qui s'est avéré un outil précieux pour étudier la fonction des gènes et comme thérapeutique.
Chez Caenorhabditis elegans, la protéine transmembranaire multipasse, la protéine défectueuse d'interférence systémique 1 (SID-1), joue un rôle indispensable dans l'absorption et la délivrance d'ARN double brin (ARNdb) entre les cellules et les tissus, conduisant à l'ARNi systémique.
De plus, deux homologues humains de SID-1, le membre 1 de la famille transmembranaire SID1 (SIDT1) et SIDT2, ont été impliqués dans le transport de l'ARN. Cependant, les mécanismes moléculaires sous-jacents par lesquels SID-1 distingue spécifiquement l'ARNdb de l'ARN simple brin (ARNsb) et de l'ADN et facilite le transport ultérieur de l'ARNdb entre les cellules restent inconnus.
Les réponses à ces questions sont importantes pour comprendre l'ARNi systémique et pour faciliter les applications liées à l'ARN.
Le Dr Zhang Jiangtao, du groupe du professeur Jiang Daohua de l'Institut de physique de l'Académie chinoise des sciences, a démontré comment SID-1 reconnaît spécifiquement l'ARNdb et a fourni des informations importantes sur l'internalisation de l'ARNdb par SID-1 en combinant cryo-EM, expériences in vitro et in vivo. Les travaux sont publiés dans la revue Nature Structural &Molecular Biology .
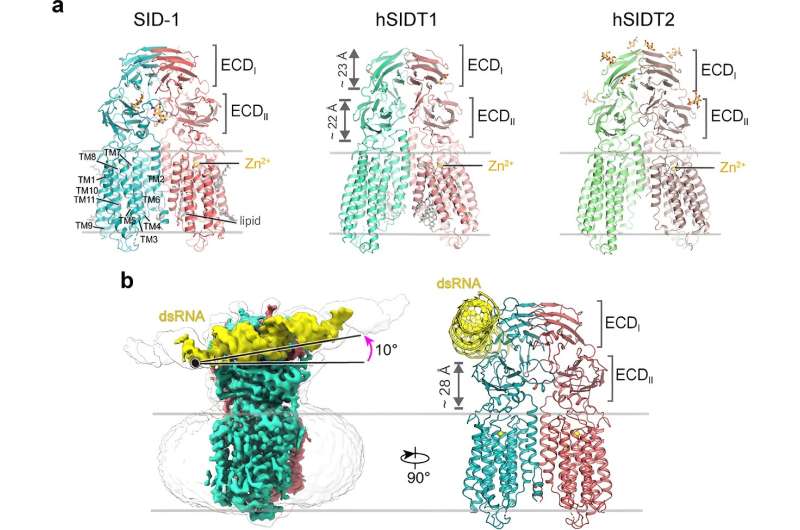
Pendant plus de deux décennies, on a pensé que SID-1 fonctionnait comme un canal d’ARNdb. Ici, les chercheurs ont résolu les structures cryo-EM haute résolution de SID-1 et des homologues humains de SID-1, SIDT1 et SIDT2, révélant l'architecture conservée de C. elegans et des homologues humains de SID-1.
Les homologues de SID-1 sont organisés de manière homo-dimérique. Étonnamment, le dimère SID-1 ne présente pas de pore évident dans le domaine transmembranaire, ce qui suggère que SID-1 pourrait ne pas fonctionner comme un canal d'ARNdb. Les tests de liaison MST ont confirmé que SID-1 peut se lier de manière puissante et spécifique à l'ARNdb, mais pas à l'ADNdb.
Par la suite, les chercheurs ont obtenu la structure cryo-EM du complexe SID-1-ARNdb, démontrant le mode de liaison détaillé de l'ARNdb et les déterminants moléculaires de la façon dont SID-1 distingue l'ARNdb de l'ARNsb et de l'ADN.
Il est intéressant de noter que de tels déterminants ne sont pas présents dans le SIDT1 ou le SIDT2 humain. Les résultats structurels ont été étayés par des études de mutagenèse utilisant des tests de liaison MST, l'absorption d'ARNdb dans les cellules S2 et des tests d'ARNi systémiques in vivo.
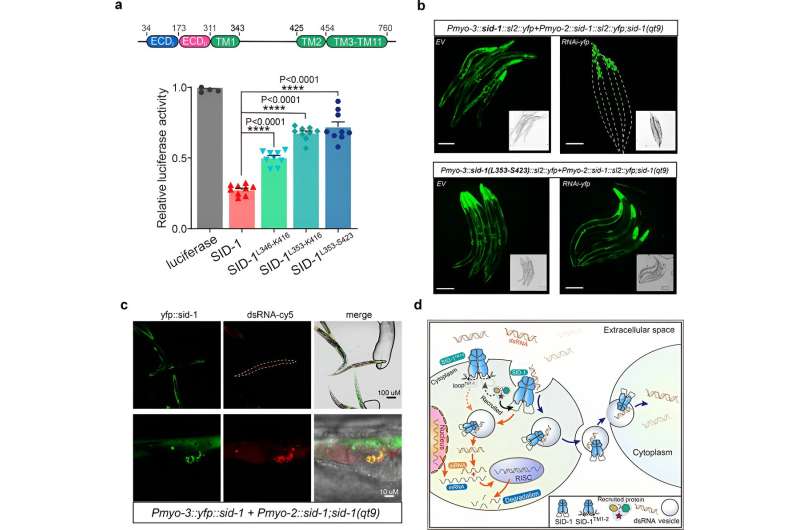
Enfin, les chercheurs montrent que la suppression des longues hélices transmembranaires 1 et 2 de la boucle intracellulaire n’a pas affecté la dimérisation du SID-1, la localisation cellulaire ou la liaison de l’ARNdb, mais elle a considérablement altéré la capture de l’ARNdb dans les cellules S2 et l’ARNi systémique chez C. elegans.
De plus, la colocalisation a révélé que SID-1 et l'ARNdb se colocalisent dans des organites subcellulaires ressemblant à des vésicules. Sur la base de ces résultats, les chercheurs proposent que SID-1 fonctionne comme un récepteur d'ARNdb et facilite l'internalisation ultérieure de l'ARNdb en recrutant des protéines liées aux endocytaires via la longue boucle.
Plus d'informations : Jiangtao Zhang et al, Aperçu structurel de la reconnaissance et du transport de l'ARN double brin par SID-1, Nature Structural &Molecular Biology (2024). DOI :10.1038/s41594-024-01276-9
Informations sur le journal : Biologie structurale et moléculaire de la nature
Fourni par l'Académie chinoise des sciences