La pyroptose est un type de mort cellulaire programmée médiée par la famille de protéines gasdermine (GSDM), qui joue un rôle important dans la défense de l'organisme contre les infections pathogènes, l'élimination des cellules anormales ou nocives et d'autres processus. Les GSDM sont une classe conservée au cours de l'évolution de protéines porogènes qui sont largement distribuées parmi diverses bactéries, champignons, invertébrés et tous les vertébrés.
Les GSDM ont généralement une structure à deux domaines auto-inhibée. Le clivage protéolytique semble être un mécanisme universel pour l’activation de tous les GSDM. On ne sait pas s'il existe des mécanismes d'activation autres que le clivage par protéase pour les GSDM.
Dans une étude publiée dans Science , des chercheurs dirigés par le professeur Ding Jingjin de l'Institut de biophysique de l'Académie chinoise des sciences et le professeur Shao Feng de l'Institut national des sciences biologiques ont révélé de nouveaux mécanismes d'activation indépendante du clivage de deux types de protéines GSDM provenant d'eucaryotes inférieurs.
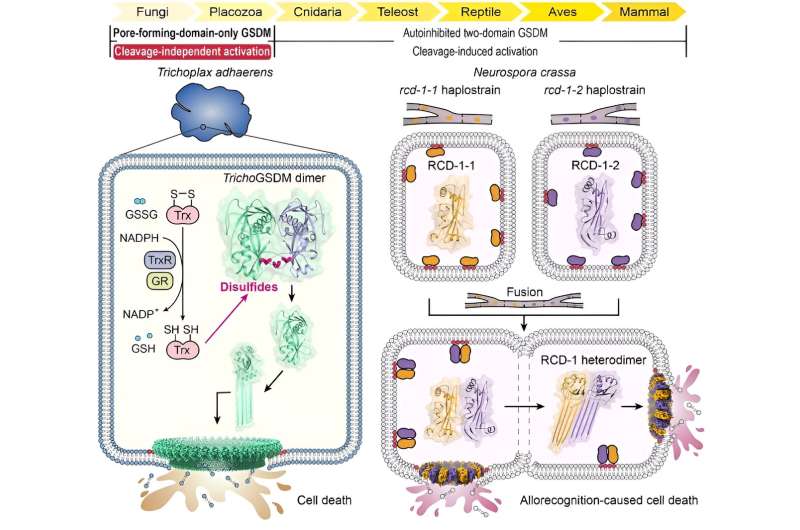
Grâce à une analyse approfondie de l'homologie de séquence, les chercheurs ont d'abord identifié une protéine GSDM dans le métazoaire basal Trichoplax adhaerens (TrichoGSDM) qui contient uniquement un domaine porogène. La caractérisation du TrichoGSDM purifié a révélé que cette protéine GSDM existe sous deux états :monomère et homodimère, seule la protéine monomère ayant la capacité de former des pores sur les liposomes.
Les analyses structurelles et biochimiques ont révélé que l'homodimère à liaison disulfure représente l'état auto-inhibiteur du TrichoGSDM, qui est activé à l'état monomère en réduisant les liaisons disulfure, en oligomérisant davantage et en formant des pores sur la membrane cellulaire pour induire la mort cellulaire de type pyroptose. Ce nouveau mécanisme d'activation, découvert dans TrichoGSDM, est le premier du genre dans toute la famille GSDM.
En outre, les chercheurs se sont concentrés sur un autre type de protéine GSDM à domaine uniquement porogène appelée RCD-1, qui a été récemment identifiée chez le champignon filamenteux Neurospora crassa. RCD-1 contient deux protéines homologues, RCD-1-1 et RCD-1-2 dans différentes souches, régissant la mort cellulaire fongique induite par l'alloreconnaissance.
Ils ont découvert que les protéines RCD-1 liées à la membrane existent dans un état de repos inactif lorsqu'elles sont laissées seules. Cependant, lorsque différentes souches subissent une fusion cellulaire, les deux protéines RCD-1 se rencontrent et s'assemblent en un hétérodimère grâce à une reconnaissance intermoléculaire spécifique, formant ainsi des pores hétérooligomères sur la membrane cellulaire pour exécuter une mort cellulaire de type pyroptose.
Dans cette étude, TrichoGSDM et RCD-1 représentent deux types de GSDM à domaine uniquement porogène dérivés d'eucaryotes simples et anciens qui utilisent des mécanismes d'activation distincts indépendants du clivage.
TrichoGSDM est un dimère auto-inhibé lié au disulfure et est activé par la réduction des disulfures, suggérant une fonction rédox-sensible. L'activité porogène du RCD-1 est stimulée par l'hétéro-reconnaissance entre le RCD-1-1 et le RCD-1-2 provenant de souches fongiques génétiquement incomparables, sous-tendant la mort cellulaire induite par l'alloreconnaissance chez N. crassa.
Les divers mécanismes d'activation suggèrent que les protéines GSDM peuvent répondre à un large éventail de signaux physiologiques et participer à de multiples processus biologiques. De plus, ces protéines GSDM à domaine uniquement porogène ont le potentiel d'être développées en tant que nouveaux outils pour induire la mort cellulaire indépendamment du clivage de la protéase, facilitant ainsi la recherche fondamentale et translationnelle liée à la pyroptose.
Plus d'informations : Yueyue Li et al, Activation indépendante du clivage des anciennes gasdermines eucaryotes et mécanismes structurels, Science (2024). DOI : 10.1126/science.adm9190
Informations sur le journal : Sciences
Fourni par l'Académie chinoise des sciences