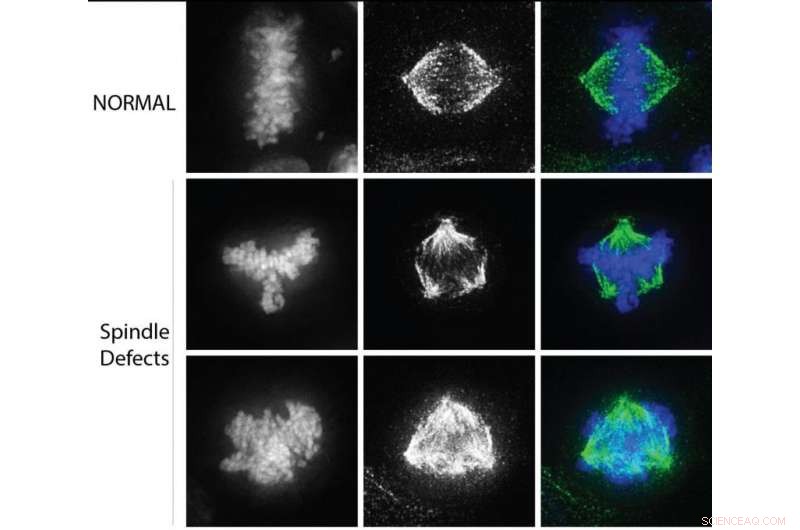
Dans les cellules cancéreuses, des défauts dans le fuseau bipolaire conduisent à tirer les chromosomes dans plusieurs directions au cours de la division cellulaire. Crédit :Université Northwestern
Les scientifiques de Northwestern Medicine ont révélé le rôle que joue la méthylation amino-terminale dans une protéine spécifique du centromère, une région du chromosome importante dans la division cellulaire, et comment le dérèglement de cette protéine peut affecter le développement des cellules cancéreuses. La méthylation des chaînes latérales d'acides aminés est bien documentée, mais le rôle de la méthylation amino-terminale est beaucoup moins bien compris.
Publié dans Communication Nature , l'étude a montré cette modification post-traductionnelle de la protéine, protéine centromère A (CENP-A), la distingue d'une protéine similaire que l'on trouve dans le reste du chromosome. CENP-A est un type d'histone, une protéine avec de l'ADN enroulé autour d'elle, et spécifie l'emplacement du centromère dans le noyau.
Auteur principal Daniel Foltz, '01 Doctorat, professeur agrégé de biochimie et de génétique moléculaire, et son équipe ont réalisé des analyses fonctionnelles des modifications sur CENP-A, qu'ils avaient préalablement identifiés.
"C'est intéressant parce qu'il s'agit d'un nouveau type de modifications sur les histones et parce que nous pouvons entrer et vraiment montrer quelle fonction est médiée par la méthylation amino-terminale, qui n'a pas été préalablement bien défini pour ce type de modification, " a déclaré Foltz.
Les enquêteurs ont découvert que le CENP-A, lorsqu'il est correctement méthylé sur son extrémité aminée, influence le recrutement des protéines CCAN, qui font partie d'un grand complexe centromère de protéines. Ils ont montré qu'un sous-ensemble de composants du CCAN dépend de cette méthylation. Lorsque les scientifiques ont bloqué la méthylation de ce processus, ils ont observé des défauts dans la ségrégation des chromosomes.
« Nous avons vraiment défini un bras de recrutement pour les protéines CCAN différent de celui qui avait été compris auparavant, " a déclaré Foltz.
Surexpression de CENP-A dans le cancer
Prochain, les scientifiques ont étudié les caractéristiques des cellules cancéreuses, y compris des défauts dans la ségrégation des chromosomes et la polarité du fuseau. Un fuseau bipolaire est essentiel pour séparer de manière égale les chromosomes en deux cellules distinctes au cours de la division cellulaire. Dans les cellules cancéreuses, les défauts du fuseau conduisent à des chromosomes qui sont tirés dans plusieurs directions et peuvent entraîner une rupture des chromosomes et une instabilité génomique. Les scientifiques ont découvert que la réduction de la quantité de méthylation de CENP-A entraîne ce processus.
Foltz et les autres chercheurs ont également découvert qu'en l'absence de la protéine suppresseur de tumeur p53, la perte de la méthylation de CENP-A favorise une formation tumorale plus rapide.
Prochain, Foltz et son équipe veulent étudier comment les cellules tumorales utilisent cette voie.
"Ce que nous avons fait dans cet article, c'est créer ce défaut dans les cellules pour voir quel est le phénotype, " Foltz a déclaré. " La question suivante est ce qui arrive à la méthylation CENP-A dans les cellules cancéreuses, et lorsque CENP-A est surexprimé, dans quelle mesure est-il à l'origine de l'instabilité génomique des cancers ? »