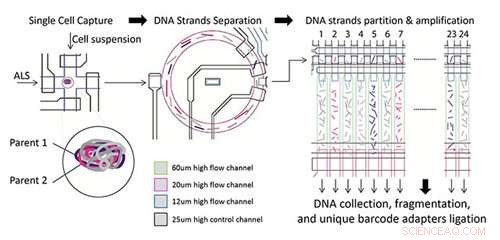
Présentation du processus expérimental utilisant la technologie SISSOR. Cellule unique en suspension identifiée par imagerie et capturée, puis les molécules d'ADN chromosomique sont séparées en forme simple brin, qui sont ensuite répartis au hasard et répartis dans 24 chambres MDA et poussés dans une chambre remplie d'air et une solution de réaction. La réaction MDA se produit après l'application de chaleur à l'appareil à 30 degrés C pendant la nuit, avant la collecte et le traitement dans une bibliothèque de séquençage à code-barres. Crédit :Université de Californie - San Diego
Une équipe interdisciplinaire de chercheurs de l'Université de Californie à San Diego a développé une technologie pour le séquençage et l'haplotypage très précis de génomes à partir de cellules humaines uniques. Leurs conclusions ont été publiées en ligne avant la Actes de l'Académie nationale des sciences ( PNAS ) édition imprimée.
« Un séquençage précis de cellules individuelles permettra d'identifier les mutations à l'origine du cancer et des maladies génétiques, " a déclaré l'auteur principal Kun Zhang, professeur de bio-ingénierie à la UC San Diego Jacobs School of Engineering. "À la fois, un haplotypage précis permettra le génotypage des haplotypes, combinaisons de différents gènes ou allèles en tant que groupe de l'un ou l'autre des parents. »
Les co-auteurs de Zhang du Département de bio-ingénierie comprennent le professeur Xiaohua Huang et le chercheur postdoctoral et ancien élève Wai Keung Chu (M.S., doctorat '11, '16), qui est le premier auteur de l'article du PNAS. Les collaborateurs à la recherche du Département d'informatique et d'ingénierie (CSE) comprennent le professeur Vineet Bafna, qui est un expert en bioinformatique au Center for Microbiome Innovation et au CHO Systems Biology Center, tous deux à l'UC San Diego, doctorat l'étudiant Peter Edge, et ancien élève du CSE Vikas Bansal (Ph.D. '08), maintenant membre du corps professoral du CSE et professeur de pédiatrie à la faculté de médecine de l'UC San Diego. L'ancien élève du Département de génie électrique et informatique (ECE) Ho Suk Lee (M.S., doctorat '11, '15), maintenant chez Broadcom, qui a apporté son expertise dans les dispositifs microfluidiques pour l'analyse unicellulaire ainsi que des années de travail dans les laboratoires de bio-ingénierie des professeurs Zhang et Huang.
Les applications cliniques du séquençage du génome exigent une grande précision dans le séquençage de l'ADN. Selon Bafna du CSE, jusqu'à maintenant, de nombreuses applications étaient interdites car les technologies actuelles n'étaient pas suffisamment précises pour être effectuées au niveau de la seule cellule humaine.
"De nombreux individus sont porteurs d'allèles qui provoquent des maladies génétiques ou les prédisposent au cancer, " dit Bafna. "Chaque gène a deux allèles, un de chaque parent. L'un des allèles peut contenir des mutations pathogènes. Les porteurs peuvent être asymptomatiques, mais leur progéniture peut présenter des symptômes dus à la combinaison de mauvais allèles ou d'haplotypes des deux parents."
Prenons le cas des couples souhaitant tomber enceinte par fécondation in vitro (FIV). "Pour les diagnostics génétiques avant l'implantation de FIV, il s'agit d'une vie humaine, donc la plus grande précision est requise, " a expliqué le professeur de bio-ingénierie Xiaohua Huang. " Avec notre technologie, nous pouvons effectuer un séquençage et un haplotypage très précis du génome sur la base d'une seule biopsie cellulaire à partir d'embryons précoces. »
En plus du diagnostic préimplantatoire de FIV et de la détection précoce du cancer, D'autres applications potentielles de la technologie développée par l'UC San Diego incluent la vérification de haute qualité des cellules humaines modifiées par le génome à des fins thérapeutiques. "Avec l'explosion de l'utilisation de CRISPR/Cas9 et d'autres techniques ciblées d'édition du génome, les nouveaux traitements pourraient être des versions modifiées des propres cellules du patient, " a déclaré Wai Keung Chu, premier auteur et doctorant en bio-ingénierie. " La technologie permet d'utiliser une seule cellule du gène " édité " et de renvoyer des résultats qui seraient aussi précis que si nous avions séquencé de nombreuses cellules. "
La technologie en question présente deux aspects nouveaux :un processeur microfluidique qui permet la manipulation de cellules individuelles et de brins chromosomiques séparés dans différentes chambres; et des méthodes de calcul qui exploitent les informations de brin pour l'haplotypage et la correction d'erreurs. Les scientifiques de l'UC San Diego l'ont surnommé "Séquençage à brin unique utilisant des réacteurs microfluidiques" (SISSOR).
"Essentiellement, il permet le séquençage simultané de très longs fragments des quatre brins de l'ADN chromosomique des deux parents, " a expliqué Peter Edge, étudiant au doctorat en bioinformatique du CSE, qui travaille dans le laboratoire de sciences de l'information sur le génome du professeur de pédiatrie Vikas Bansal. "Cela nous permet de faire des comparaisons et de corriger les erreurs."
La technique SISSOR brise également ce qu'on a appelé la "malédiction des polymérases", qui introduisent des erreurs lors de la réalisation de copies d'ADN. Malheureusement, a noté Bafna du CSE, « nous ne pouvons pas lire les informations du génome à partir de cellules individuelles sans polymérases, nous avons donc dû trouver une solution qui élimine ces erreurs."
Sur la base de leurs découvertes, les co-auteurs de l'article du PNAS ont pu démontrer "le séquençage du génome unicellulaire le plus précis à ce jour".
L'auteur principal Kun Zhang affirme que la nature interdisciplinaire de la collaboration de recherche était essentielle pour trouver un moyen plus précis de séquencer l'ADN à partir de cellules individuelles. "Notre approche peut fournir simultanément une plus grande précision et des haplotypes plus longs que les autres approches existantes, " a conclu Zhang. " Cette innovation a nécessité une expertise qui va au-delà de ce qui existe normalement dans un seul département, et ce cas témoigne de la culture de recherche interdisciplinaire croissante de l'UC San Diego qui nous a permis d'attirer des collaborateurs d'autres départements qui étaient essentiels à une technologie dont les bénéfices seront, espérons-le, mesurés en vies sauvées - et peut-être plus d'enfants en bonne santé nés via in vitro fertilisation."