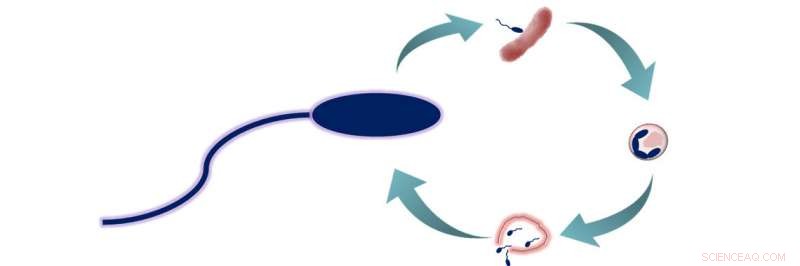
Cycle de prédation de B. bacteriovorus. B. bacteriovorus a deux phases de vie :1) la recherche de proies, et 2) entrer dans la proie et se nourrir. Au cours de cette deuxième phase, les bactéries consomment leurs proies de l'intérieur, leur permettant de croître et de s'allonger avant de se séparer en 3 à 6 nouvelles cellules de B. bacteriovorus. Ces cellules échappent alors à la proie désormais morte et commencent un nouveau cycle de vie. Crédit :Société chimique américaine
En 2016, l'Organisation mondiale de la santé a désigné la résistance aux antibiotiques comme « l'une des plus grandes menaces pour la santé mondiale, la sécurité alimentaire, et le développement aujourd'hui. » L'annonce citait une liste croissante d'infections, comme la tuberculose et la gonorrhée, qui deviennent chaque année plus difficiles à traiter à mesure que la résistance aux traitements antibiotiques actuels augmente. Pourtant, les antibiotiques sont essentiels - sans eux, la race humaine serait en proie à des infections persistantes. Alors, quelle est la solution pour assurer un traitement continu tout en faisant face à la montée alarmante des résistances ?
Une solution potentielle réside dans un type unique de bactéries prédatrices qui se nourrissent d'autres bactéries, comme celles qui causent des maladies. Surnommés « antibiotiques vivants, " ce groupe de faune carnivore a retenu l'attention des chercheurs, y compris ceux de l'Okinawa Institute of Science and Technology Graduate University (OIST). Dans un article récemment publié dans ACS Biologie Synthétique , Les chercheurs de l'OIST ont fait les premiers pas vers la manipulation génétique d'un de ces minuscules cannibales, B. bacteriovorus. Ils ont identifié des outils pouvant permettre la manipulation de gènes qui influencent le comportement prédateur de cette bactérie.
"À l'avenir, nous voulons contrôler la prédation des bactéries - le moment et l'étendue de la prédation, " explique le Dr Mohammed Dwidar de l'unité de chimie et d'ingénierie des acides nucléiques et premier auteur de l'article. " [Pour le moment] nous manquons des outils d'ingénierie de base pour le faire. "
B. bacteriovorus est inoffensif pour l'homme mais mortel pour ses proies - les bactéries à Gram négatif - qui comprennent des méchants tels que E. coli, Salmonelle, Legionella, et d'autres. En tant que tel, être capable de le contrôler pourrait potentiellement traiter de nombreux types d'infections. Cependant, en raison de sa nature prédatrice inhabituelle et d'autres caractéristiques uniques, la manipulation génétique de B. bacteriovorus a été limitée.
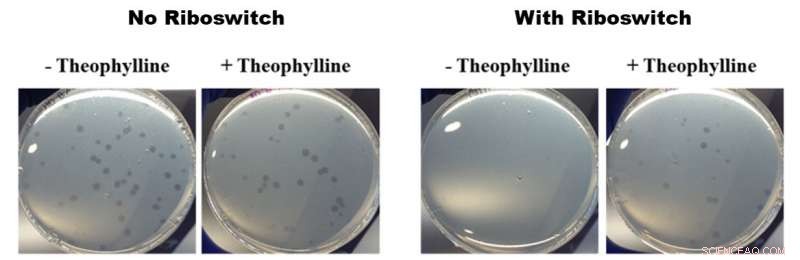
Effets des riboswitchs activés par la théophylline sur la croissance de B. bacteriovorus. Toutes les photos de la figure ci-dessus montrent des boîtes de Pétri contenant B. bacteriovorus et ses proies E. coli. Les deux photos de gauche montrent la croissance de B. bacteriovorus dans des boîtes ne contenant pas (-) et contenant (+) de la théophylline sans riboswitch inséré dans le génome. Les deux photos de droite montrent la croissance de B. bacteriovorus modifié avec un riboswitch dans des boîtes ne contenant pas (-) et contenant (+) de la théophylline. Les photos de gauche ne montrent aucune différence de croissance et les photos de droite montrent une croissance plus rapide en présence de théophylline, ce qui signifie que les riboswitchs activés par la théophylline ont eu un effet sur le comportement prédateur de B. bacteriovorus. Crédit :Société chimique américaine
Les chercheurs de l'OIST ont utilisé des riboswitchs, qui sont des outils de contrôle de l'expression génique connus pour bien fonctionner dans d'autres bactéries, relever le défi de comprendre et de manipuler la prédation de B. bacteriovorus. La façon dont un gène est exprimé suit une voie spécifique :l'ADN est converti en ARN par transcription, L'ARN est converti en protéines par traduction, puis les protéines remplissent différentes fonctions. Le riboswitch intervient lors de la phase de traduction. En plaçant un riboswitch au début d'un brin d'ARN, puis "l'activer" avec un produit chimique, le riboswitch peut démarrer ou arrêter la traduction de l'ARN en une protéine.
Pour leur étude, les chercheurs de l'OIST ont inséré un riboswitch dans l'un des gènes considérés comme importants pour le comportement prédateur de B. bacteriovorus :le flagellaire sigma factor fliA. Ils l'ont ensuite activé avec la théophylline chimique. Après avoir placé les bactéries modifiées dans des boîtes de Pétri avec de délicieuses proies E. coli, le B. bacteriovorus modifié semble se multiplier plus rapidement en présence de théophylline qu'en son absence. Cette multiplication plus rapide implique que B. bacteriovorus consommait ses proies plus rapidement, et se multiplient ainsi plus rapidement. Cela montre à son tour que le cycle de vie prédateur peut être contrôlé par la théophylline.
En plus de l'objectif final « antibiotique vivant », il existe de nombreuses autres utilisations potentielles pour les cellules de B. bacteriovorus facilement manipulables. "Les gens veulent des aliments biologiques sans produits chimiques, " explique le Dr Dwidar. " Les bactéries prédatrices peuvent être une alternative potentiellement sûre aux agents antibactériens pour certaines maladies des plantes. Nous pouvons également l'utiliser pour l'industrie, par exemple, dans les stations d'épuration."
"À l'avenir, vous pourriez vaporiser ces bactéries sur des aliments frais pour vous protéger contre les intoxications alimentaires, " Professeur Yohei Yokobayashi, qui a également participé à la recherche, ajoute.
Forts des résultats des chercheurs de l'OIST, la prochaine étape consiste à en savoir plus sur B. bacteriovorus et les outils qui pourraient être en mesure de contrôler son comportement afin de réaliser un jour tout son potentiel antibiotique.