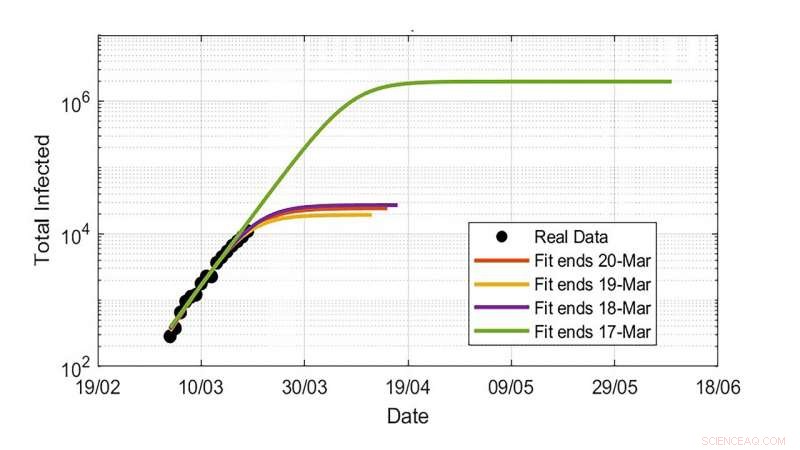
Les estimations du nombre total de dénombrements d'infections à l'aide d'infections au COVID-19 au Royaume-Uni. Les extrapolations montrent d'énormes fluctuations en fonction de l'ampleur du dernier point de données disponible. Crédit :Davide Faranda
Alors que le virus infectieux à l'origine de la maladie COVID-19 a commencé sa propagation dévastatrice dans le monde entier, une équipe internationale de scientifiques s'est alarmée du manque d'approches uniformes des épidémiologistes de divers pays pour y répondre.
Allemagne, par exemple, n'a pas institué un verrouillage complet, contrairement à la France et au Royaume-Uni, et la décision aux États-Unis de New York d'entrer dans un verrouillage n'est intervenue qu'après que la pandémie ait atteint un stade avancé. La modélisation des données pour prédire le nombre d'infections probables variait considérablement d'une région à l'autre, du très grand au très petit nombre, et a révélé un degré élevé d'incertitude.
Davide Faranda, chercheur au Centre National de la Recherche Scientifique (CNRS), et collègues au Royaume-Uni, Mexique, Danemark, et le Japon a décidé d'explorer les origines de ces incertitudes. Ce travail est profondément personnel à Faranda, dont le grand-père est décédé de COVID-19 ; Faranda lui a dédié le travail.
Dans la revue le chaos , le groupe explique pourquoi la modélisation et l'extrapolation de l'évolution des épidémies de COVID-19 en temps quasi réel est un énorme défi scientifique qui nécessite une compréhension approfondie des non-linéarités sous-jacentes à la dynamique des épidémies.
Prévoir le comportement d'un système complexe, comme l'évolution des épidémies, nécessite à la fois un modèle physique pour son évolution et un ensemble de données d'infections pour initialiser le modèle. Pour créer un modèle, l'équipe a utilisé les données fournies par le Centre de science et d'ingénierie des systèmes de l'Université Johns Hopkins, qui est disponible en ligne à l'adresse https://systems.jhu.edu/research/public-health/ncov/ ou https://github.com/CSSEGISandData/COVID-19.
"Notre modèle physique est basé sur l'hypothèse que la population totale peut être divisée en quatre groupes :ceux qui sont susceptibles d'attraper le virus, ceux qui ont contracté le virus mais ne présentent aucun symptôme, ceux qui sont infectés et, finalement, ceux qui se sont rétablis ou sont morts du virus, " dit Faranda.
Pour déterminer comment les gens passent d'un groupe à un autre, il faut connaître le taux d'infection, temps d'incubation et temps de récupération. Les données d'infection réelles peuvent être utilisées pour extrapoler le comportement de l'épidémie avec des modèles statistiques.
"En raison des incertitudes dans les deux paramètres impliqués dans les modèles - taux d'infection, période d'incubation et temps de récupération - et l'incomplétude des données sur les infections dans les différents pays, les extrapolations pourraient conduire à une gamme incroyablement large de résultats incertains, " dit Faranda. " Par exemple, le simple fait de supposer une sous-estimation des dernières données du nombre d'infections de 20 % peut entraîner une modification des estimations totales des infections de quelques milliers à quelques millions d'individus. »
Le groupe a également montré que cette incertitude est due à un manque de qualité des données et aussi à la nature intrinsèque de la dynamique, car il est ultrasensible aux paramètres, notamment pendant la phase initiale de croissance. Cela signifie que tout le monde doit être très prudent en extrapolant les quantités clés pour décider s'il faut mettre en œuvre des mesures de verrouillage lorsqu'une nouvelle vague de virus commence.
"Le nombre total d'infections finales ainsi que la durée de l'épidémie sont sensibles aux données que vous saisissez, " il a dit.
Le modèle de l'équipe gère l'incertitude de manière naturelle, ils prévoient donc de montrer comment la modélisation de la phase post-confinement peut être sensible aux mesures prises.
"Les résultats préliminaires montrent que la mise en œuvre de mesures de verrouillage lorsque les infections sont dans une phase de croissance exponentielle complète pose de sérieuses limites à leur succès, " dit Faranda.