
Une nouvelle recherche du MIT décrit comment les micro-organismes marins contribuent à une couche de nitrite juste en dessous de la zone ensoleillée de l'océan. Crédit : Institut de technologie du Massachusetts
L'azote est un produit chaud dans l'océan de surface. Les producteurs primaires dont le phytoplancton et d'autres micro-organismes le consomment et le transforment en molécules organiques pour construire la biomasse, tandis que d'autres transforment des formes inorganiques pour accéder à leur réserve chimique d'énergie. Toutes ces étapes font partie du cycle complexe de l'azote de la colonne d'eau supérieure.
Environ 200 mètres plus bas, juste en dessous de la zone ensoleillée de l'océan, réside une couche de nitrite, un composé intermédiaire dans le cycle de l'azote. Les scientifiques ont trouvé cette fonctionnalité robuste, appelé maximum de nitrite primaire, dans tous les océans oxygénés du monde. Alors que plusieurs hypothèses individuelles ont été avancées, aucun n'a expliqué de manière convaincante cette signature marine jusqu'à présent.
Une récente Communication Nature étude menée par des chercheurs du Programme Atmosphères, Océans et Climat (PAOC) au sein du Département de la Terre du MIT, Les sciences atmosphériques et planétaires (EAPS) utilisent la théorie, la modélisation, et des données d'observation pour étudier les mécanismes écologiques produisant l'accumulation de nitrite observée et dictant son emplacement dans la colonne d'eau. L'auteur principal Emily Zakem—une ancienne étudiante diplômée de l'EAPS qui est maintenant postdoctorante à l'Université de Californie du Sud—ainsi que la chercheuse principale de l'EAPS Stephanie Dutkiewicz et le professeur Mick Follows montrent que les contraintes physiologiques et la compétition des ressources entre le phytoplancton et les micro-organismes nitrifiants dans la couche ensoleillée peut donner ce trait océanique.
Régulation de la pompe biologique
Malgré sa faible concentration océanique, le nitrite (NO2-) joue un rôle clé dans les cycles mondiaux du carbone et de l'azote. La majeure partie de l'azote dans l'océan réside sous la forme inorganique de nitrate (NO3-), que les producteurs primaires et les micro-organismes le réduisent chimiquement pour construire des molécules organiques. La reminéralisation se produit lorsque le processus inverse a lieu :le phytoplancton et d'autres bactéries hétérotrophes décomposent ces composés organiques en ammonium (NH4+), une forme d'azote inorganique. L'ammonium peut alors être à nouveau consommé par les producteurs primaires, qui tirent leur énergie de la lumière. D'autres micro-organismes appelés chimioautotrophes utilisent également l'ammonium à la fois pour fabriquer une nouvelle biomasse et comme source d'énergie. Pour faire ça, ils extraient l'oxygène de l'eau de mer et la transforment, un processus appelé nitrification, qui se déroule en deux étapes. D'abord, les microbes transforment l'ammonium en nitrite puis en nitrate.
Quelque part le long de la ligne, du nitrite s'est accumulé à la base de la zone ensoleillée, qui a des implications pour la biogéochimie océanique. "Largement, nous essayons de comprendre ce qui contrôle la reminéralisation de la matière organique dans l'océan. C'est cette reminéralisation qui est responsable de la formation de la pompe biologique, qui est le stockage supplémentaire de carbone dans l'océan dû à l'activité biologique, " dit Zakem. C'est cette forte influence que l'azote a sur le cycle global du carbone qui capte l'intérêt de Follows. est stocké dans l'océan. La croissance du phytoplancton sur l'ammonium est appelée production recyclée, qui n'augmente pas le stockage du carbone océanique, " Suits dit. " Nous souhaitons donc comprendre ce qui contrôle les taux d'approvisionnement et la consommation relative de ces différentes espèces d'azote. "
Bataille pour l'azote
Le maximum de nitrite primaire réside entre deux groupes de micro-organismes dans la plupart des océans du monde. Au-dessus, dans la zone ensoleillée se trouvent le phytoplancton, et dans le maximum de nitrite primaire et légèrement en dessous, une abondance de microbes nitrifiants dans une zone avec des taux élevés de nitrification. Les chercheurs classent ces microbes en deux groupes en fonction de leur source d'azote préférée :les organismes oxydant l'ammonium (AOO) et les organismes oxydant le nitrite (NOO). Dans les hautes latitudes comme les régions subpolaires de la Terre, le nitrite s'accumule dans la zone ensoleillée de surface ainsi qu'en profondeur.
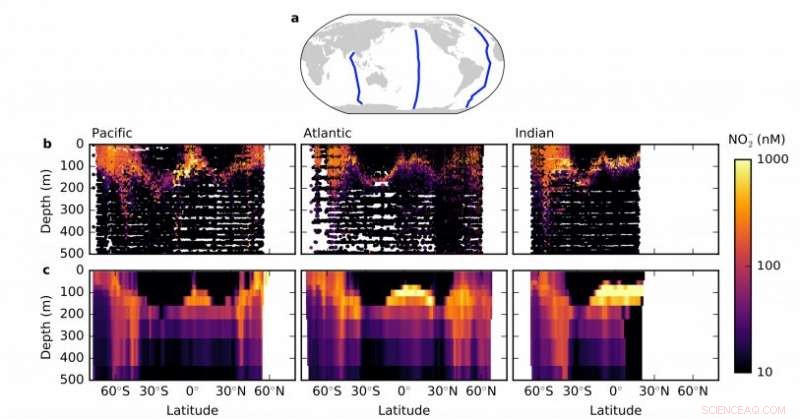
Un modèle d'écosystème montre les concentrations de nitrite par profondeur (profil vertical) sur trois transects océaniques. Crédit : Institut de technologie du Massachusetts
Les scientifiques ont postulé qu'il pourrait y avoir deux raisons non exclusives l'une de l'autre pour l'accumulation de nitrite :la nitrification par des microbes chimiotrophes, et en cas de stress, le phytoplancton peut réduire les nitrates en nitrites. Étant donné que les preuves isotopiques ne soutiennent pas ce dernier, le groupe s'est penché sur le premier.
"L'hypothèse de longue date était que les emplacements de nitrification étaient contrôlés par l'inhibition de la lumière de ces micro-organismes [nitrifiants], de sorte que les micro-organismes qui effectuent ce processus ont été restreints à la surface, " Zakem dit, ce qui implique que ces chimioautotrophes nitrifiants ont été brûlés par le soleil. Mais au lieu de supposer que c'était vrai, le groupe a examiné les interactions écologiques entre ces organismes et d'autres dans l'océan de surface, laisser la dynamique tomber naturellement. Pour ce faire, ils ont collecté des échantillons microbiens du Pacifique Nord subtropical et les ont évalués pour les taux de métabolisme, efficacités et abondances, et évalué les besoins physiologiques et les contraintes des différents microbes nitrifiants en réduisant la complexité biologique de leurs métabolismes à sa chimie sous-jacente et en émettant ainsi l'hypothèse de certaines des contraintes les plus fondamentales. Ils ont utilisé ces informations pour informer la dynamique des microbes nitrifiants dans un modèle biogéochimique unidimensionnel et tridimensionnel.
Le groupe a découvert qu'en utilisant ce cadre, ils pourraient résoudre les interactions entre ces chimioautotrophes nitrifiants et le phytoplancton et donc simuler l'accumulation de nitrite au maximum de nitrite primaire aux endroits appropriés. Dans l'océan de surface lorsque l'azote inorganique est un facteur limitant, les microbes oxydants du phytoplancton et de l'ammonium ont des capacités similaires à acquérir l'ammonium, mais parce que le phytoplancton a besoin de moins d'azote pour croître et a un taux de croissance plus rapide, ils sont capables de surpasser les nitrifiants, en les excluant de la zone ensoleillée. De cette façon, ils ont pu fournir une explication écologique de l'endroit où la nitrification se produit sans avoir à se fier à l'inhibition de la lumière dictant l'emplacement.
La comparaison des physiologies fondamentales des nitrifiants a révélé que les différences dans les métabolismes et la taille des cellules pourraient expliquer l'accumulation de nitrite. Les chercheurs ont découvert que la deuxième étape du processus de nitrification effectuée par les oxydants de nitrite nécessite plus d'azote pour la même quantité de biomasse créée par ces organismes, ce qui signifie que les oxydants d'ammoniac peuvent faire plus avec moins, et qu'il y a moins d'oxydants au nitrite que les oxydants à l'ammoniac. Les microbes oxydant les nitrites ont également une contrainte surface/volume plus élevée que les microbes oxydants de l'ammonium plus petits et omniprésents, rendant l'absorption d'azote plus difficile. "C'est une explication alternative pour pourquoi le nitrite devrait s'accumuler, " dit Zakem. " Nous avons deux raisons qui vont dans le même sens. Nous ne pouvons pas distinguer lequel c'est, mais toutes les observations sont cohérentes avec l'un ou l'autre de ces deux ou une combinaison des deux étant le contrôle. »
Les chercheurs ont également pu utiliser un modèle climatique global pour reproduire une accumulation de nitrite dans la zone ensoleillée de lieux comme les régions subpolaires, où le phytoplancton est limité par une autre ressource que l'azote comme la lumière ou le fer. Ici, les nitrifiants peuvent coexister avec le phytoplancton car il y a plus d'azote à leur disposition. En outre, la couche profonde de mélange dans l'eau peut puiser des ressources loin du phytoplancton, donnant aux nitrifiants une meilleure chance de survie en surface.
"Il y a cette hypothèse de longue date que les nitrifiants ont été inhibés par la lumière et c'est pourquoi ils n'existent qu'en sous-sol, " dit Zakem. " Nous disons que nous avons peut-être une explication plus fondamentale :que cette légère inhibition existe parce que nous l'avons observée, mais c'est une conséquence de l'exclusion à long terme de la surface."
Voir plus grand
"Cette étude a rassemblé la théorie, simulations numériques, et des observations pour démêler et fournir une description quantitative et mécaniste simple de certains phénomènes qui étaient mystérieux dans l'océan, " Follows dit. " Cela nous aide à démêler le cycle de l'azote, qui a un impact sur le cycle du carbone. Cela a également ouvert la voie à l'utilisation de ce type d'outils pour répondre à d'autres questions de l'océanographie microbienne. » Il note que le fait que ces microbes détournent l'ammonium en nitrate près de la zone éclairée par le soleil complique l'histoire du stockage du carbone dans l'océan.
Deux chercheurs qui n'ont pas participé à l'étude, Karen Casciotti, professeur agrégé au Département des sciences du système terrestre de l'Université de Stanford, et Angela Landolfi, un scientifique du département de modélisation biogéochimique marine du GEOMAR Helmholtz Center for Ocean Research de Kiel, se mettre d'accord. "Cette étude est d'une grande importance car elle fournit des preuves de la façon dont les traits individuels des organismes affectent les interactions compétitives entre les populations microbiennes et fournissent un contrôle direct sur la distribution des nutriments dans l'océan, " dit Landolfi. " En substance, Zakem et al., fournir une meilleure compréhension du lien entre les différents niveaux de complexité de l'individu à la communauté jusqu'au niveau environnemental, fournir un cadre mécanistique pour prédire les changements dans la composition des communautés et leur impact biogéochimique sous les changements climatiques, " dit Landolfi.
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.