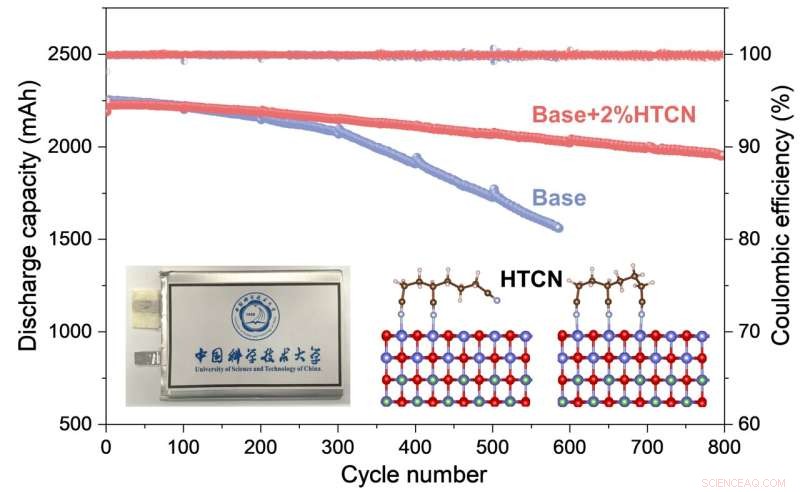
Les performances électrochimiques et le mécanisme de travail de l'additif HTCN sur LiCoO haute tension2 cathode pour les cellules de poche pratiques sont étudiées de manière approfondie. Crédit :Nano Research
Les nitriles - un composé organique avec un atome de carbone triplement lié à un atome d'azote - sont généralement ajoutés à la formule d'électrolyte des batteries utilisant une cathode d'oxyde de lithium-cobalt, ce qui rapproche ces batteries de la réalisation de leurs performances théoriques complètes. Jusqu'à présent, les chercheurs en batteries n'ont pas vraiment compris pourquoi ces nitriles fonctionnent de cette manière. Mais un groupe d'électrochimistes a utilisé des techniques de microscopie avancées pour examiner de plus près ce qui se passe à l'échelle moléculaire et identifié ce qui se passe, ouvrant de nouvelles voies pour encore plus d'améliorations des performances de la batterie.
L'étude a été publiée dans la revue Nano Research le 22 septembre 2022..
Oxyde de lithium-cobalt (LiCoO2 , ou simplement "LCO") est le matériau le plus largement utilisé pour les cathodes - les électrodes positives - dans les batteries lithium-ion. Cela est particulièrement vrai pour les batteries utilisées dans les appareils électroniques portables grâce à la haute tension de fonctionnement du LCO, sa grande capacité et la stabilité de ses performances sur le long terme.
Mais ce qui a rendu les cathodes LCO particulièrement attrayantes, c'est qu'elles offrent plus d'énergie pour une plus petite quantité d'espace (plus grande densité d'énergie), ce qui est très utile pour les petits appareils grand public tels que les téléphones, les montres intelligentes et les gadgets qui ont des contraintes d'espace encore plus strictes telles que comme capteurs intelligents domestiques et industriels.
Cependant, à l'heure actuelle, les cathodes LCO ne peuvent fournir qu'environ la moitié de leur capacité spécifique théorique. Cela signifie que ce qu'ils fournissent réellement est bien inférieur à ce qu'ils devraient théoriquement être capables de produire. C'est pourquoi ils ont souvent du mal à répondre aux demandes croissantes de densité énergétique de l'électronique portable.
Une façon de contourner cet obstacle serait d'augmenter la tension de charge limitée des batteries utilisant des cathodes LCO. La tension de charge limitée décrit le point auquel une batterie est considérée comme complètement chargée. Au-delà de ce point, la batterie pourrait être endommagée et de nombreux appareils s'éteignent simplement lorsque le seuil de coupure est atteint. Ce seuil est fixé de manière quelque peu arbitraire, et il pourrait donc être augmenté, et un tel fonctionnement à haute tension est prometteur pour donner un coup de pouce à la densité d'énergie de ces batteries.
Mais ici un nouveau problème se pose :le fonctionnement à haute tension peut exacerber les réactions chimiques nocives à l'interface entre la cathode et l'électrolyte. Cela peut entraîner des fissures et d'autres dommages internes, qui à leur tour peuvent détériorer davantage l'interface entre les électrodes. En fin de compte, tout cela peut entraîner une baisse radicale de la capacité de la batterie et une forte augmentation des problèmes de sécurité. La température de fonctionnement de ces appareils peut atteindre 45℃ en raison de leur propre génération de chaleur, ce qui réduit encore la durée de vie de la batterie.
Et donc depuis un certain temps maintenant, mélanger des composés supplémentaires à la formule de l'électrolyte pour ajuster l'activité de réaction de l'électrolyte (le milieu contenant des ions qui aide à établir un courant via le mouvement des ions positifs et négatifs à travers lui) à l'interface entre la cathode et l'électrolyte s'est avéré être une stratégie très efficace pour diminuer l'activité de réaction de l'électrolyte.
Il existe un certain nombre de composés différents utilisés comme additifs électrolytiques, mais pour les batteries lithium-ion, les nitriles sont peut-être les plus largement utilisés. Les nitriles sont tout composé organique dont une partie de la molécule (un groupe fonctionnel) est constituée d'un atome de carbone triplement lié à un atome d'azote.
Cependant, le mécanisme de fonctionnement des additifs de nitrile sur les cathodes haute tension n'est pas encore entièrement compris, en particulier dans le type de batteries à poche LCO haute tension pratiques et quotidiennes. (Les batteries en sachet sont un type de batterie "souple" sans boîtier en métal dur, et à la place dont les composants sont enfermés dans un film plastique recouvert d'aluminium, ressemblant un peu à une "poche" de chewing-gum ou de tabac en vrac. Développé pour la première fois en 1995 et permettant une utilisation beaucoup plus efficace de l'espace, les batteries de poche sont depuis devenues un choix courant pour les fabricants en raison de cet avantage de conception.)
Il existe deux théories principales qui tentent d'expliquer le mécanisme des additifs nitriles, mais les deux présentent des lacunes importantes dans leur pouvoir explicatif.
"Les nitriles fonctionnent bien, mais nous ne savons pas vraiment pourquoi ils fonctionnent bien, pourquoi cette action stabilisatrice se produit. Ce qui se passe exactement est resté assez mystérieux", a déclaré Shuhong Jiao, électrochimiste à l'Université des sciences et technologies de Chine. (USTC). "Et si nous ne savons pas pourquoi ce que nous faisons pour améliorer les batteries fonctionne, cela nous empêche d'ajuster nos efforts pour améliorer encore les choses."
Les chercheurs ont donc pris un additif d'électrolyte nitrile commun, le 1,3,6-hexanetricarbonitrile (ou plus simplement HTCN) contenant un ligand tridenté pour essayer de faire la lumière sur le mécanisme des nitriles dans la stabilisation à haute tension d'un LiCoO2 cathode.
Pendant que la batterie fonctionnait et surpassait de loin un équivalent sans les additifs d'électrolyte HTCN, les chercheurs ont utilisé la microscopie électronique pour examiner de plus près ce qui se passait, combinée à une analyse de la composition ionique et élémentaire du système. Ils ont découvert que l'additif HTCN inhibait très efficacement la génération de fissures et la dissolution des ions cobalt.
Ensuite, en utilisant la spectroscopie photoélectronique à rayons X combinée à une série de calculs théoriques, ils ont découvert que les molécules de HTCN étaient efficacement adsorbées (collées à) la surface du LCO et intégrées à l'interface entre la cathode et l'électrolyte, qui dans inhiber fortement une réaction d'oxydation à la surface du LCO, empêchant ainsi une décomposition continue de l'électrolyte.
Au total, cela équivaut à une interface beaucoup plus stable entre la cathode et l'électrolyte, ce qui a considérablement supprimé la décomposition des composants et la formation de fissures. C'est cette structure cathode-électrolyte stable et dense qui améliore la stabilité de la batterie à travers un grand nombre de cycles de charge et de décharge.
Connaissant cette compréhension au niveau moléculaire de la façon dont les additifs nitriles donnent un coup de pouce à ces batteries, les chercheurs peuvent désormais rechercher d'autres formulations d'additifs électrolytiques qui produisent une structure d'interface similaire ou meilleure. Les additifs chimiques améliorent la stabilité des batteries lithium-ion haute densité