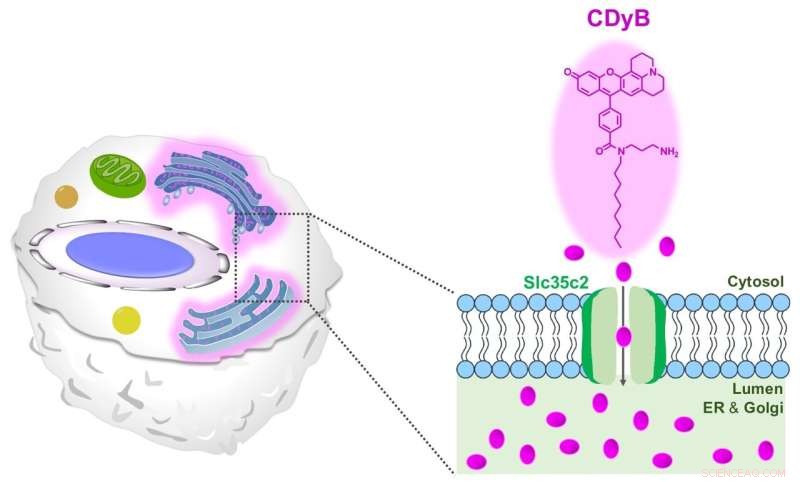
Le mécanisme de coloration proposé de CDyB. Crédit :Institut des sciences fondamentales
Notre système immunitaire est essentiel à notre survie, car notre corps est constamment exposé à des bactéries, virus, parasites et autres agents pathogènes. Sans système immunitaire, nous perdrions rapidement la guerre contre ces agents pathogènes et succomberions à ces envahisseurs extérieurs. Le système immunitaire est composé de milliards de globules blancs individuels qui circulent dans notre circulation sanguine et se déplacent dans nos tissus, patrouillant à la recherche de signes d'infection ou de lésions tissulaires. Les défenses de l'organisme consistent en de nombreux types différents de globules blancs, notamment les lymphocytes, les monocytes et les granulocytes. Les lymphocytes sont à leur tour subdivisés en cellules T, cellules B et cellules NK.
L'identification de chaque type cellulaire est essentielle pour comprendre leurs rôles spécifiques et mener des recherches dans le domaine de l'immunologie. Les lymphocytes T et B sont deux cellules immunitaires adaptatives majeures dans les systèmes de défense de notre corps. Cependant, la taille et la forme similaires des cellules rendent difficile leur distinction. Actuellement, la distinction des différents types de cellules se fait en colorant les cellules à l'aide d'anticorps fluorescents qui se lient à différents groupes de récepteurs de différenciation (CD) à la surface des cellules.
Maintenant, une équipe dirigée par le professeur Chang Young-Tae du Centre d'auto-assemblage et de complexité de l'Institut des sciences fondamentales de Pohang, en Corée du Sud, a développé avec succès une sonde à petite molécule CDyB (qui signifie Compound of Designation yellow for B cell ) qui peut accomplir la distinction entre les cellules B vivantes et les cellules T. CDyB a été découvert à l'aide d'un criblage de bibliothèque de fluorescence impartiale appelée Diversity Oriented Fluorescence Library, ou DOFL. En utilisant ce processus, les chercheurs ont pu cribler des milliers de molécules différentes pour leur spécificité à un type de cellule immunitaire plutôt qu'à un autre. Appliquée à un mélange de lymphocytes T et B, cette nouvelle sonde s'est avérée avoir une sélectivité élevée envers les lymphocytes B.
Le CDyB est un nouveau type de sonde qui ne nécessite pas d'anticorps spécifiques au CD pour distinguer différents types de cellules. Au contraire, il s'est avéré capable de pénétrer dans la cellule elle-même et de colorer le réticulum endoplasmique (RE) et l'appareil de Golgi, qui sont des organites proéminents dans les cellules qui sont responsables du transport des matériaux dans les cellules. On pense que cela est possible grâce à la capacité de la molécule à traverser facilement les membranes cellulaires.
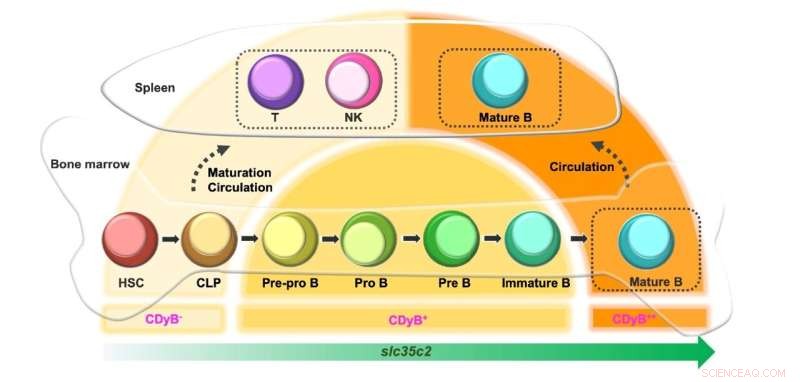
Schéma de l'intensité de fluorescence CDyB en fonction du développement des lymphocytes B. Crédit :Institut des sciences fondamentales
Après avoir réalisé que CDyB est localisé dans les organites ER / Golgi, les chercheurs ont émis l'hypothèse que le mécanisme de la sélectivité des lymphocytes B est basé sur le déclenchement. En d'autres termes, certaines molécules de transport doivent être responsables de l'absorption et de l'accumulation du CDyB à l'intérieur des organites de certaines cellules, mais pas des autres. C'est pourquoi ils ont inventé le nouveau terme, distinction des cellules vivantes orientées vers le déclenchement (GOLD) pour décrire ce mécanisme nouvellement découvert de distinction des différents types de cellules.
Ensuite, les chercheurs ont cherché à savoir pourquoi le CDyB ne colore que les organites des cellules B, mais pas les cellules T. Les chercheurs ont exploré plus en détail le mécanisme de la nouvelle sonde en utilisant une bibliothèque basée sur SLC-CRISPR, qui est une plate-forme qui offre de fortes chances d'élucidation systématique de la cible de déclenchement. En utilisant SLC-CRISPRa et SLC-CRISPRi, les chercheurs ont découvert que SLC35C2 était le transporteur spécifique de CDyB, qui permet à la molécule d'être transportée à l'intérieur des organites. Le transporteur cible a ensuite été validé par l'analyse de l'expression génique. Les chercheurs ont réalisé d'autres expériences d'inactivation et ont montré que la suppression du transporteur supprimait la capacité de la molécule à être internalisée par le RE / Golgi des cellules cibles, prouvant le rôle de SlC35C2 pour la sélectivité des cellules B.
Fait intéressant, les chercheurs ont observé que le signal CDyB était plus fort dans les cellules B matures que dans les cellules B immatures. Ceci est probablement dû à l'augmentation de l'expression de SLC35C en fonction de la maturité des cellules B. Les cellules progénitrices telles que les cellules souches hématopoïétiques (HSC) et les progéniteurs lymphoïdes communs (CLP) expriment un faible niveau de SLC35C2 et sont donc peu colorées par CDyB. Lorsqu'ils se différencient en cellules T et NK, l'expression de SLC35C2 reste faible, d'où une faible fluorescence CDyB. Si les cellules se différencient en lignées de cellules B, l'expression de SLC35C2 augmente au cours de la voie de maturation. Les progéniteurs de cellules B partiellement différenciés (Pre-Pro B, Pro B, Pre B) présentent une fluorescence CDyB modérée, et les cellules B entièrement matures affichent le niveau le plus élevé de fluorescence CDyB.
Notamment, l'équipe du professeur Chang a précédemment déverrouillé une autre sonde sélective des lymphocytes B appelée CDgB (composé de désignation verte pour les cellules B) l'année dernière. Contrairement au CDyB, il distingue les lymphocytes B des lymphocytes T à l'aide du mécanisme LOLD (Lipid-Oriented Live-cell Distinction). LOLD utilise la petite différence dans les composants membranaires, tels que la longueur de la chaîne carbonée et la teneur en cholestérol, et la flexibilité pour la discrimination cellulaire. Alors que CDyB a montré une fluorescence plus forte dans les cellules B matures, CDgB a montré la coloration la plus brillante dans les cellules B immatures en raison de leur structure membranaire plus douce. On espère que l'utilisation conjointe de ces deux molécules avec des mécanismes peut être un moyen efficace de distinguer différents types de cellules dans les cellules sanguines.
Cette étude enrichit la boîte à outils des sondes moléculaires et la compréhension moléculaire de la distinction des cellules B vivantes et ouvre la possibilité d'une analyse cellulaire multidimensionnelle basée sur le mécanisme orthogonal avec de nouvelles perspectives. Ce travail a été publié dans Angewandte Chemie International Edition le 5 juillet. Une nouvelle sonde fluorescente qui permet de distinguer les lymphocytes B des lymphocytes T