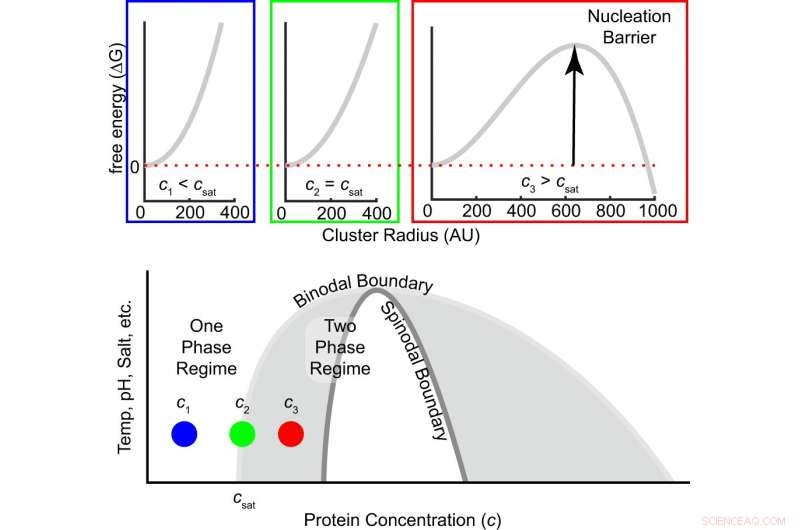
Fig. 1 :La barrière d'énergie libre à la nucléation dépend du degré de sursaturation. L'énergie libre en fonction de la taille des amas est indiquée en haut pour trois concentrations, c'est à dire., au dessous de, à et au-dessus de la concentration de saturation. Lorsque la concentration augmente de subsaturée à la concentration saturée à sursaturée, le signe de la différence d'énergie libre entre une molécule à l'intérieur et à l'extérieur d'un amas passe du positif au négatif, et une barrière de nucléation finie émerge (Eq. (1)). La région grise à l'intérieur du binodal est métastable, ce qui signifie que la nucléation est nécessaire pour former des amas de phase dense qui se développent jusqu'à ce que l'équilibre soit atteint. Le régime blanc à l'intérieur du spinodal est instable, ce qui signifie que la solution se décompose spontanément en phases diluées et denses. Crédit :DOI :10.1038/s41467-021-24727-z
Les scientifiques du St. Jude Children's Research Hospital étudient la séparation en phase liquide-liquide (LLPS), un processus biophysique par lequel les protéines et les acides nucléiques d'une cellule sont compartimentés sans membrane. Le travail fournit de nouvelles informations sur la façon dont la force des forces qui entraînent la séparation des phases est liée à la vitesse à laquelle elle se produit. Les résultats ont été publiés aujourd'hui dans Communication Nature .
Les cellules doivent trier et organiser les protéines et autres composants. Une façon de le faire est via LLPS, un processus similaire à la façon dont l'huile forme des gouttelettes dans l'eau. organites sans membrane, corps dans une cellule qui se comportent comme des gouttelettes liquides, organiser certaines protéines sans les enfermer dans une membrane. Au lieu, les protéines sont maintenues ensemble par les forces biophysiques qui entraînent la LLPS.
On sait peu de choses sur la façon dont les biomolécules passent d'une solution à une phase à un mélange à deux phases, dans un processus appelé nucléation. Ce processus a été difficile à évaluer car il nécessite d'examiner des échelles de temps extrêmement rapides (de la microseconde à la milliseconde). Par conséquent, la plupart des études se sont plutôt penchées sur l'évolution au sein de systèmes déjà en régime diphasique (comment les gouttelettes fusionnent et se développent).
"Nous pouvons voir au cours de ces moments très précoces que même les molécules de protéines désordonnées individuelles qui se séparent en phase ont des propriétés assez différentes de celles des protéines désordonnées qui ne se séparent pas en phase, " a déclaré l'auteur co-correspondant Tanja Mittag, Doctorat., Département de biologie structurale de St. Jude.
Des recherches à St. Jude et ailleurs ont montré que la LLPS peut être impliquée dans des maladies neurodégénératives telles que la sclérose latérale amyotrophique (SLA) et le cancer. Une meilleure compréhension de LLPS peut finalement conduire à des opportunités de cibler thérapeutiquement des parties du processus.
Les mesures de temps en microsecondes offrent une nouvelle compréhension
L'opinion dominante de la LLPS en biologie est qu'un changement dans les conditions cellulaires peut conduire spontanément à la nucléation, commutation d'une solution monophasée en deux phases. Dans cette recherche, les scientifiques ont utilisé un système simplifié, avec une seule protéine dans l'eau et le sel, pour étudier si le changement s'est réellement produit de cette manière ou si des étapes supplémentaires sont nécessaires pour démarrer le processus.
Avec une technique appelée mélange rapide, résolu dans le temps, diffusion des rayons X aux petits angles (TR-SAXS), les chercheurs ont pu observer les premières étapes du processus. Ils ont examiné la nucléation d'un domaine de type prion appelé A1-LCD à partir de la protéine hnRNPA1. Des mutations de cette protéine provoquent la SLA et d'autres maladies.
Les scientifiques ont montré comment des grappes de A1-LCD se forment, et comment ces clusters mènent à LLPS. Les résultats indiquent que la nucléation contient des étapes distinctes, différenciés par la taille du cluster. En regardant les plus petits amas (avec peu de molécules individuelles), les scientifiques ont découvert que le comportement de l'assemblage différait de la théorie classique de la nucléation. Ces écarts expliquent potentiellement pourquoi la séparation de phase de certaines biomolécules peut se produire en quelques millisecondes alors qu'elle prend des heures pour d'autres.
"Même dans un système simplifié, il faut quand même prendre en compte ce genre d'effets non idéaux aux premiers stades de la nucléation, " a déclaré l'auteur co-correspondant Erik Martin, Doctorat., Département de biologie structurale de St. Jude. "Avant de commencer à penser à l'assemblage par séparation de phases ou à la condensation dans les cellules, vous devez penser aux choses à partir d'un niveau moléculaire. Il y aura des étapes initiales pour cet assemblage qui ne sont pas prises en compte dans les modèles précédents. »