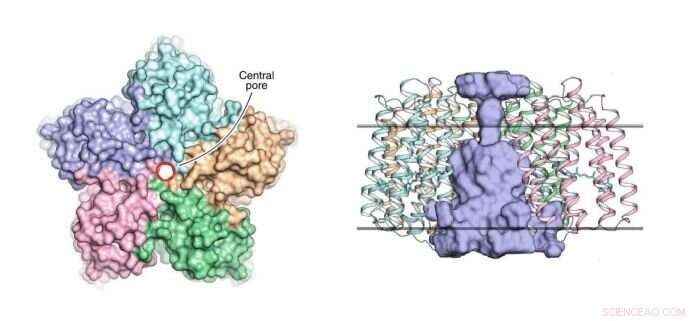
A gauche :une vue du pentamère OLPVRII du côté cytoplasmique. Le pore central est entouré d'un cercle rouge. A droite :une vue latérale du pentamère. Le pore central est de couleur bleu clair. Les limites du noyau de la membrane hydrophobe/hydrophile sont représentées par des lignes horizontales pleines. Crédit :Dmitry Bratanov et al./Nature Communications
La structure d'une rhodopsine II de Phycodnavirus organique des lacs (OLPVRII), qui est une protéine unique trouvée dans le génome des virus géants, a été déterminé grâce au travail des diplômés du MIPT et du doctorat. étudiants. Le document a été publié en Communication Nature .
L'étude est le résultat d'une collaboration qui comprenait de nombreux anciens élèves du MIPT. Dmitry Bratanov était parmi eux. Dmitry, qui travaille actuellement à l'Institut des Systèmes Complexes (ICS-6) au Centre de Recherche Juelich, Allemagne, dit que bien que les rhodopsines virales aient été découvertes pour la première fois dans les virus dits géants il y a plusieurs années, leur structure, fonction, et le rôle biologique sont restés incertains jusqu'à présent.
Un virus géant est un très gros virus, la taille d'une bactérie typique. Il est si gros qu'il est visible au microscope optique. Les virus géants infectent les algues vertes, qui produisent de l'oxygène et aident à maintenir l'équilibre écologique naturel de l'océan mondial. Par conséquent, les virus géants sont d'un intérêt considérable pour la recherche d'un point de vue environnemental.
"Dans ce travail, nous avons déchiffré la structure haute résolution d'OLPVRII, caractérisé fonctionnellement la protéine, et a montré qu'il forme des pentamères non seulement dans les cristaux mais aussi dans les membranes lipidiques, " explique Dmitry. " Ce n'était pas une tâche facile. De nombreuses expériences ont dû être réalisées, pour certains d'entre eux, nous avons utilisé des techniques et des équipements sophistiqués. Ce que nous avons réalisé est le résultat du travail acharné et méticuleux du groupe international de scientifiques."
Cette organisation pentamère a déjà été observée dans d'autres rhodopsines, tel que, par exemple, dans la pompe à sodium KR2. Cependant, ce qui rend la structure OLPVRII particulière, c'est qu'elle a un pore inhabituel au centre (voir figure 1). Sa fonction reste inconnue.
"Nous pensons que peut-être le pore agit comme un canal ionique, très probablement pour les ions chlorure, " dit Kirill Kovalev, un co-auteur de l'article et Ph.D. étudiant au MIPT.
Les canaux ioniques sont des protéines qui créent une voie passive permettant aux ions de traverser la membrane cellulaire. Ces canaux sont généralement fermés dans l'obscurité, ce qui signifie que les ions ne peuvent pas entrer ou sortir de la cellule. Dans le cas des canaux photosensibles, ils s'ouvrent en réponse à l'absorption de la lumière, qui permet aux ions de descendre le gradient de concentration. En d'autres termes, les ions se déplacent dans la direction qui égaliserait les concentrations d'ions à l'intérieur et à l'extérieur de la cellule.
Un exemple typique de canal sensible à la lumière est la channelrhodopsine 2. Elle a été trouvée dans l'algue verte Chlamydomonas reinhardtii et est largement utilisée comme outil optogénétique. Quant à l'OLPVRII, les chercheurs pensent qu'il pourrait s'agir du premier canal ionique pentamérique à barrière lumineuse jamais découvert, comme suggéré par la structure déterminée et les simulations moléculaires.
"Toutefois, l'activité de canal d'OLPVRII n'a pas encore été démontrée, " note Kirill Kovalev." Nous poursuivrons nos recherches et découvrirons certainement pourquoi cette rhodopsine inhabituelle a été créée par la nature. Peut-être que cela aide l'hôte à continuer d'exercer ses fonctions vitales lorsqu'une cellule est infectée par un virus, ou peut-être que c'est un capteur."
Cela dit, l'étude de la structure de la rhodopsine virale a permis de mieux comprendre son fonctionnement. Il a été montré que l'OLPVRII, comme la plupart des autres rhodopsines, agit comme une pompe à protons. Il est cependant peu probable que ce soit sa fonction principale, disent les chercheurs. Son objectif principal doit encore être étudié et prouvé.
"Si nous prouvons que cette rhodopsine virale est en fait un canal ionique, il peut devenir un excellent outil dans les applications optogénétiques et biomédicales, " déclare le co-auteur de l'article Valentin Gordeliy, qui dirige des groupes de recherche à l'Institut de biologie structurale de Grenoble et au Centre de recherche Juelich. Valentin est également coordinateur de recherche au Centre de recherche du MIPT sur les mécanismes moléculaires du vieillissement et les maladies liées à l'âge.
Les chercheurs disent que le nouvel outil surpassera tous ses homologues grâce aux avantages de sa structure pentamérique :la facilité avec laquelle vous pouvez manipuler génétiquement les propriétés de la protéine et peut-être les courants élevés circulant à travers le pore central.
Avoir le droit prioritaire d'exploiter leur invention, les auteurs de l'article ont déposé une demande de brevet pour l'utilisation de la rhodopsine virale OLPVRII dans le domaine de l'optogénétique.
L'optogénétique est une branche de la biophysique qui utilise la lumière pour contrôler les cellules d'un organisme vivant. Comme cela a déjà été démontré, l'optogénétique peut être appliquée pour restaurer la vision et la perte auditive, aider à contrôler les mouvements chez les patients neurologiques, et traiter les personnes atteintes de la maladie de Parkinson et d'Alzheimer.
Selon Valentin Gordeliy, Le MIPT dispose de tous les équipements nécessaires pour mener une étude détaillée des fonctions de la rhodopsine virale. Le groupe poursuivra ses recherches sur OLPVRII, qui sera d'une grande importance pour la biologie, science de l'évolution, optogénétique, et l'écologie.