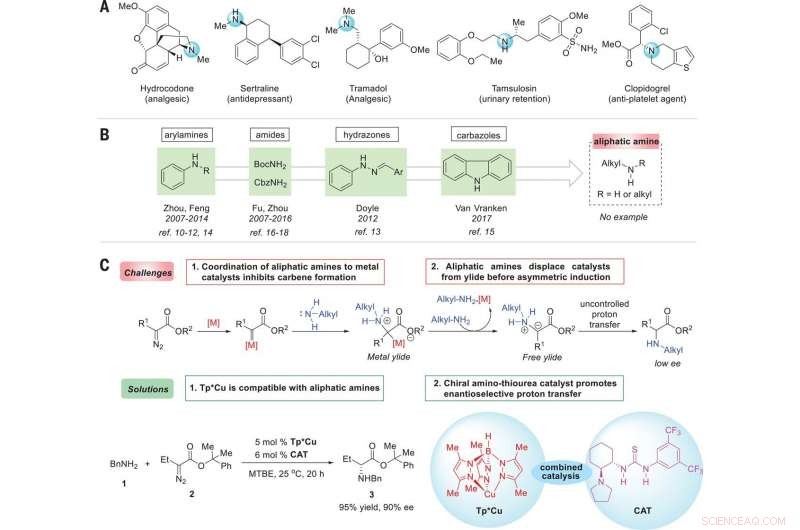
Stratégie d'énantiocontrôle des réactions d'insertion N-H des amines aliphatiques avec les carbènes. (A) Médicaments représentatifs démontrant l'ubiquité des amines aliphatiques chirales dans les molécules bioactives. (B) Sources d'amine signalées pour les réactions d'insertion énantiosélectives de N-H. (C) Réactions énantiosélectives d'insertion de N-H catalysées par des métaux de transition avec des amines aliphatiques:défis et solutions. Conditions de réaction optimales :La réaction de 1 (0,2 mmol), 2 (0,22 mmol), Tp*Cu (5 moles %), et la CAT (6 % en moles) a été réalisée dans 3 ml de méthyl tert-butyl éther (MTBE) à 25°C pendant 20 heures. BnNH2, benzylamine; BocNH2, carbamate de tert-butyle; CbzNH2, carbamate de benzyle; Moi, méthyle; Et, éthyle; Ph, phényle; M, métal; réf., référence. Crédit: Science (2019). doi:10.1126/science.aaw9939
Une équipe de chimistes de l'Université de Nankai a développé une approche en deux étapes pour convertir les amines aliphatiques en acides aminés non naturels. Dans leur article publié dans la revue Science , le groupe décrit sa démarche, à quel point cela a fonctionné, et les applications qui pourraient bénéficier de son utilisation. John Ovian et Eric Jacobsen de l'Université Harvard ont publié un article complémentaire dans le même numéro de revue décrivant certains des obstacles à la création de liaisons avec de riches réactifs azotés; il décrit également l'approche utilisée par l'équipe en Chine.
Les chercheurs ont commencé par noter que les amines chirales sont utilisées dans une grande variété de produits naturels, et de souligner qu'ils sont également tout aussi largement utilisés dans l'agrochimie et la pharmacie. Ils notent que 43% des 200 médicaments sur ordonnance les plus prescrits en 2016 avaient au moins une fraction amine analiphatique. Ils notent en outre qu'à cause de cela, développer des réactions énantiosélectives catalysées par des métaux de transition qui forment des liaisons C-N sont d'un grand intérêt dans les cercles de la chimie.
Comme le notent Ovian et Jacobsen, les chimistes utilisent une variété de composés qui ont des liaisons carbone-azote dans l'une des deux orientations possibles d'image miroir. Mais comme ils le soulignent également, cela peut présenter des difficultés dues à l'interaction de l'azote avec un catalyseur donné. Dans ce nouvel effort, les chercheurs ont trouvé un moyen de contourner ce problème en développant une approche en deux étapes pour convertir les amines aliphatiques en acides aminés non naturels. Dans leur approche, ils ont appliqué un catalyseur au cuivre pour servir de moyen d'activation d'un réactif au carbone, puis ont ajouté un catalyseur de thiourée qui était une liaison hydrogène pour produire des produits à haute sélectivité. Ils notent que le succès de la transformation dépendait des propriétés uniques des deux catalyseurs. Ils rapportent en outre que la réaction qui en a résulté devrait fonctionner aussi bien avec une large gamme de dérivés diazo d'un partenaire de couplage ester/amine.
Ovian et Jacobsen notent en outre que l'association d'une amine avec un carbénoïde permettait la stabilisation par un groupe carboxyle et offrait un bon moyen de créer des dérivés d'acides -aminés non naturels. La méthode trace également une voie pour étendre les insertions de carbénoïdes catalysées par des métaux dans les liaisons N-H aux amines aliphatiques et représente le potentiel de développement de nouvelles transformations asymétriques.
© 2019 Réseau Science X