Crédit :Université Rice
Les scientifiques de l'Université Rice qui disent que les capteurs biologiques ne sont pas assez sensibles font quelque chose à ce sujet.
Le laboratoire du biologiste synthétique Jeffrey Tabor a introduit une nouvelle technique pour augmenter ou diminuer la sensibilité des systèmes à deux composants - une classe de protéines que les bactéries utilisent pour détecter une grande variété de stimuli.
La technique pourrait permettre l'ingénierie de biocapteurs sur mesure pour le diagnostic des bactéries intestinales, détection de polluants environnementaux ou contrôle automatisé des niveaux de nutriments dans le sol.
Capteurs à deux composants, l'objet d'un nouvel article décrivant le travail de Nature Communications, sont une grande famille de capteurs génétiquement codés que les bactéries utilisent pour détecter une entrée spécifique et activer un gène spécifique en réponse à des changements dans leur environnement.
Alors que ces capteurs sont connus depuis trois décennies, ils n'étaient pas assez sensibles pour Tabor. Lui et l'ancien élève de Rice et l'auteur principal Brian Landry ont entrepris de réduire la quantité d'entrées nécessaires pour les activer.
En combinant modélisation informatique et expérimentations, ils y sont parvenus. Dans le journal, ils décrivent leur découverte que l'activité de la phosphatase, qui est essentiel à la régulation et à la signalisation dans les cellules, peut avoir un effet dramatique sur les seuils de détection des systèmes à deux composants.
Des recherches antérieures avaient montré que les mutations du premier composant, une protéine capteur de signalisation connue sous le nom d'histidine kinase, peut être utilisé pour contrôler l'étendue de la phosphorylation du deuxième composant, une protéine régulatrice de la réponse. Mais personne n'avait suggéré que les mutations de la phosphatase pourraient être utilisées pour modifier la sensibilité de ces voies pour leurs entrées, dit Tabor.
Un jour, face à un capteur de nitrate qui ne s'allumait pas comme prévu dans l'intestin d'une souris malade, Landry a émis l'hypothèse que les mutations de la phosphatase pourraient augmenter considérablement la sensibilité de la voie.
Il a d'abord validé l'hypothèse à l'aide d'un modèle mathématique, puis a mené des expériences qui ont montré que les mutations augmentaient l'efficacité d'un capteur de nitrate d'un facteur 100. Le laboratoire de Tabor a ensuite validé l'approche dans des systèmes à deux composants qui détectent une grande variété d'entrées. , même dans des espèces de bactéries très différentes.
Landry a travaillé avec un autre étudiant en bio-ingénierie de Rice, co-auteur Lucas Hartsough, pour identifier un acide aminé « point chaud » présent dans 64 % de toutes les histidine kinases du capteur qui peuvent être muté pour régler la sensibilité. Ils ont validé l'approche dans deux voies minimalement caractérisées, qui a suggéré qu'il peut être largement appliqué, dit Tabor.
Landry a également utilisé la technologie pour fabriquer une bactérie du sol, Bacillus subtilis, pour détecter et réagir à une large gamme de concentrations de nitrate (engrais) dans le sol. Tabor et Landry suggèrent que ce système pourrait être couplé à des voies en cours de développement par un collègue du MIT, le biologiste synthétique Chris Voigt, et son laboratoire pour concevoir des bactéries du sol qui maintiennent des niveaux d'azote optimaux dans le sol sans avoir besoin d'engrais.
Les systèmes à deux composants peuvent être déclenchés par de nombreux types d'entrées, y compris les gaz, molécules d'hème dans le sang, sucres, polysaccharides intestinaux, des hormones humaines ou végétales ou encore de la lumière.
"C'est pourquoi nous sommes si excités à ce sujet, " a déclaré Tabor. " Ces capteurs fonctionnent tous de la même manière. Ils ont tous la phosphatase et la kinase. Nous en avons identifié plus de 25, 000 d'entre eux dans des génomes bactériens et nous pensons que notre stratégie fonctionnera sur la plupart d'entre eux."
Il a déclaré que la technique de son laboratoire repose sur la voie de signalisation par laquelle les molécules de capteurs naturels disent aux cellules de s'arrêter, démarrer ou modifier la production de protéines. Le réglage des capteurs naturels pour les applications synthétiques a été difficile jusqu'à présent, il a dit.
"L'une des grandes limites est que lorsque vous prenez un biocapteur dans la nature, il peut détecter le produit chimique qui vous intéresse, mais pas à la bonne concentration. C'est parce qu'il a évolué pour permettre à une bactérie de mieux survivre dans un environnement naturel plutôt que pour satisfaire les besoins d'ingénierie d'un biologiste synthétique, " il a dit.
"On appelle ce niveau le seuil de détection du capteur, et il n'y a pas eu beaucoup de bonnes technologies pour régler ce seuil pour répondre à nos besoins d'ingénierie, " a déclaré Tabor. "Cela a été une limitation majeure dans la conception des biocapteurs. Mais maintenant, nous avons trouvé une astuce générale qui nous permet d'ajuster les seuils de détection de cette famille de capteurs bactériens de manière très rationnelle, et ça marche plutôt bien."
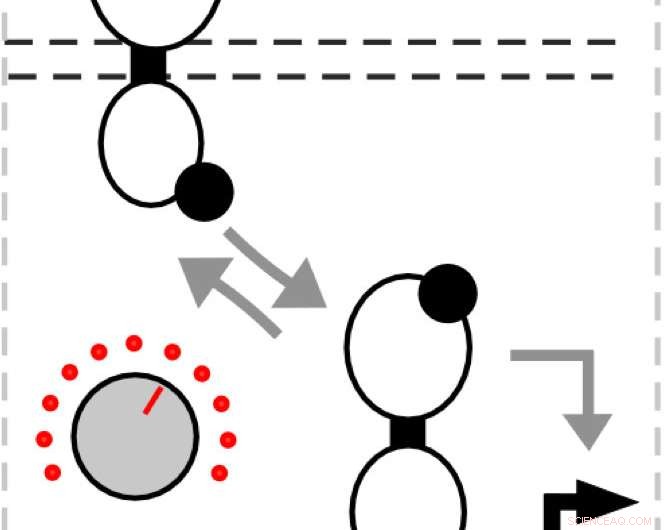
Dans ses simulations et expériences, le laboratoire a muté la protéine histidine kinase, qui détecte une entrée et libère un groupe phosphate qui se lie au régulateur de réponse. Cette, à son tour, se lie à l'ADN pour activer l'expression des gènes.
"Lorsque vous activez l'expression des gènes, c'est ton signal, " a déclaré Tabor. " Ce qui est cool avec ces voies, c'est que lorsque l'entrée est absente, l'histidine kinase du capteur agit plutôt comme une phosphatase et élimine le groupe phosphate. Quand cela arrive, le régulateur de réponse tombe de l'ADN et n'active plus l'expression du gène."
Il a dit que la mutation de l'histidine kinase pour favoriser l'activation ou la désactivation du signal peut être utilisée pour contrôler les actions des régulateurs de réponse, et donc la quantité de protéines désirées produites.
"Nous avons pensé que c'était comme un bras de fer entre l'activité kinase et l'activité phosphatase, " a déclaré Tabor. "Cet équilibre détermine la quantité d'entrée nécessaire pour activer le capteur. C'est donc comme un bouton où nous pouvons rendre l'activité de la phosphatase plus forte ou plus faible pour régler l'entrée."
Il a déclaré que la généralité du processus devrait stimuler la biologie synthétique en général. "Il existe des méthodes alternatives pour faire ce que nous avons fait ici, mais ils sont beaucoup plus intensifs en main-d'œuvre, " a déclaré Tabor. "Ils sont plus susceptibles d'échouer, et ils prendraient tout un doctorat. pour les faire travailler, alors que nous pouvons le faire en une semaine et le faire fonctionner.