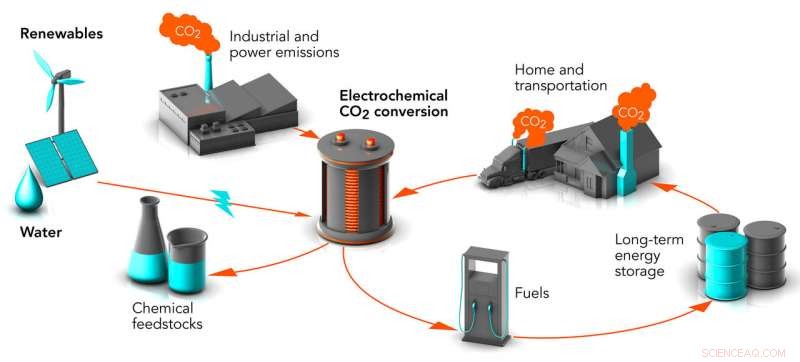
Des chercheurs de Stanford et du SLAC travaillent sur des moyens de convertir les déchets de dioxyde de carbone (CO2) en matières premières chimiques et en carburants, transformer un puissant gaz à effet de serre en produits de valeur. Le processus est appelé conversion électrochimique. Lorsqu'il est alimenté par des sources d'énergie renouvelables, il pourrait réduire les niveaux de dioxyde de carbone dans l'air et stocker l'énergie de ces sources intermittentes sous une forme utilisable à tout moment. Crédit :Greg Stewart/SLAC National Accelerator Laboratory
Une façon de réduire le niveau de dioxyde de carbone dans l'atmosphère, qui est maintenant à son point culminant en 800, 000 ans, serait de capter le puissant gaz à effet de serre des cheminées des usines et des centrales électriques et d'utiliser l'énergie renouvelable pour le transformer en choses dont nous avons besoin, dit Thomas Jaramillo.
En tant que directeur du SUNCAT Center for Interface Science and Catalysis, un institut conjoint de l'Université de Stanford et du SLAC National Accelerator Laboratory du ministère de l'Énergie, il est en mesure de contribuer à ce que cela se produise.
L'un des principaux objectifs de la recherche SUNCAT est de trouver des moyens de transformer le CO
"Nous avons déjà émis trop de CO
"Vous pourriez capturer le CO
Nous avons demandé à Nitopi, Jaramillo, Le scientifique de SUNCAT Christopher Hahn et le chercheur postdoctoral Lei Wang pour nous dire sur quoi ils travaillent et pourquoi c'est important.
Q. Tout d'abord les bases :comment convertir le CO
Tom : C'est essentiellement une forme de photosynthèse artificielle, c'est pourquoi le Centre commun pour la photosynthèse artificielle du DOE finance notre travail. Les plantes utilisent l'énergie solaire pour convertir le CO
Chris :Une façon de procéder s'appelle le CO électrochimique.
Aujourd'hui, ce procédé nécessite un catalyseur à base de cuivre. C'est le seul connu pour faire le travail. Mais ces réactions peuvent produire de nombreux produits, et séparer celui que l'on veut coûte cher, nous devons donc identifier de nouveaux catalyseurs capables de guider la réaction vers la fabrication uniquement du produit souhaité.
Comment?
Lei :Lorsqu'il s'agit d'améliorer les performances d'un catalyseur, l'un des éléments clés que nous examinons est de savoir comment les rendre plus sélectifs, ils génèrent donc un seul produit et rien d'autre. Environ 90 % de la fabrication de carburants et de produits chimiques dépendent des catalyseurs, et se débarrasser des sous-produits indésirables représente une grande partie du coût.
Nous regardons également comment rendre les catalyseurs plus efficaces en augmentant leur surface, il y a donc beaucoup plus d'endroits dans un volume donné de matière où des réactions peuvent se produire simultanément. Cela augmente le taux de production.
Récemment, nous avons découvert quelque chose de surprenant :lorsque nous avons augmenté la surface d'un catalyseur à base de cuivre en lui donnant la forme d'une « nanofleur » feuilletée, cela rendait la réaction à la fois plus efficace et plus sélective. En réalité, il n'a pratiquement produit aucun sous-produit d'hydrogène gazeux que nous puissions mesurer. Cela pourrait donc offrir un moyen d'ajuster les réactions pour les rendre plus sélectives et plus compétitives.
Stéphanie :C'était tellement surprenant que nous avons décidé de revoir toutes les recherches que nous pouvions trouver sur la catalyse du CO électrochimique
We were trying to figure out what makes copper special, why it's the only catalyst that can make some of these interesting products, and how we can make it even more efficient and selective—what techniques have actually pushed the needle forward? We also offered our perspectives on promising research directions.
One of our conclusions confirms the results of the earlier study:The copper catalyst's surface area can be used to improve both the selectivity and overall efficiency of reactions. So this is well worth considering as a chemical production strategy.
Does this approach have other benefits?
Tom:Absolutely. If we use clean, renewable energy, like wind or solar, to power the controlled conversion of waste CO
Chris:And when we use renewable energy to convert CO
How close are we to making it happen?
Tom:Chris and I explored this question in a recent Perspective article in Science , written with researchers from the University of Toronto and TOTAL American Services, which is an oil and gas exploration and production services firm.
We concluded that renewable energy prices would have to fall below 4 cents per kilowatt hour, and systems would need to convert incoming electricity to chemical products with at least 60% efficiency, to make the approach economically competitive with today's methods.
Chris:This switch couldn't happen all at once; the chemical industry is too big and complex for that. So one approach would be to start with making high-value, high-volume products like ethylene, which is used to make alcohols, polyester, antifreeze, plastics and synthetic rubber. It's a $230 billion global market today. Switching from fossil fuels to CO
The same step-by-step approach applies to sources of CO
Tom:Once you enter certain markets and start scaling up the technology, you can attack other products that are tougher to make competitively today. What this paper concludes is that these new processes have a chance to change the world.