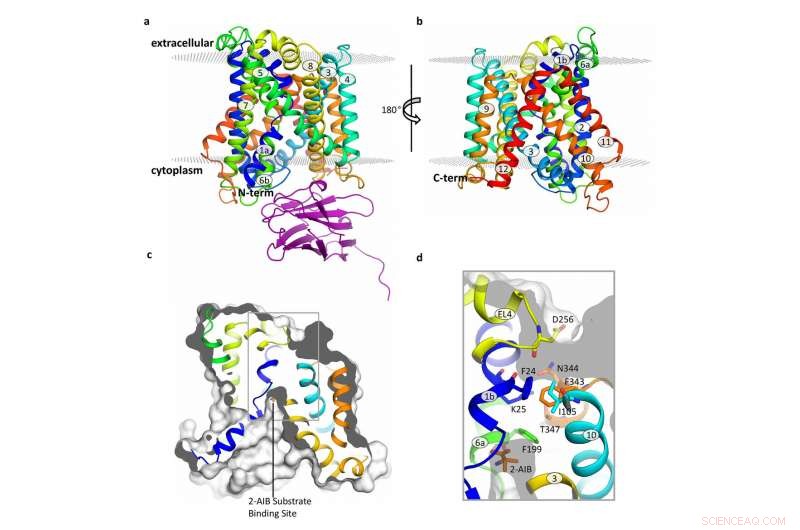
Structure du transporteur BasC. Crédit :Manuel Paladin, IRB Barcelone
Chez l'homme, il existe plus de 50 types de transporteurs d'acides aminés, qui sont responsables de la captation cellulaire des acides aminés et de la régulation de l'équilibre intra- et extra-cellulaire de ces molécules. Les mutations de ces transporteurs sont associées à diverses maladies. Cependant, malgré l'importance de ces molécules, on sait peu de choses sur leur fonctionnement. Les scientifiques de l'Institut de recherche en biomédecine (IRB Barcelone) ont maintenant caractérisé la structure d'un membre de la famille LAT.
Les LAT forment une famille qui comprend divers types de transporteurs d'acides aminés, et sont même présents dans certains types de bactéries. Les LAT mutées sont associées à des conditions aussi diverses que l'autisme, perte auditive liée à l'âge, cystinurie et intolérance aux protéines lysinuriques.
Publié dans la revue Communication Nature , cette étude s'est concentrée sur BasC, un LAT présent dans les bactéries. "Nous avons utilisé BasC comme modèle car il montre une similitude structurelle et fonctionnelle avec les LAT chez l'homme, " explique Manuel Palacín, directeur du laboratoire des transporteurs d'acides aminés et des maladies de l'IRB de Barcelone.
En analysant la structure et la fonction de BasC, les premiers auteurs de cet ouvrage, Ekaitz Errasti-Murugarren, Fort Joana et Paola Bartoccioni, stagiaires postdoctoraux à l'IRB Barcelone, ont identifié le site auquel les acides aminés se lient aux LAT et le mécanisme sous-jacent à l'interaction des deux côtés de la membrane cellulaire.
« Savoir comment les LAT reconnaissent les acides aminés à transporter dans la cellule nous permet de mieux comprendre leur fonction et de décrypter les défauts moléculaires associés à diverses conditions. Cette connaissance nous aidera ensuite à développer des traitements potentiels, " commente Palacin, professeur à la Faculté de biologie de l'Université de Barcelone, et chef de l'unité U731 du Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER).
Dans cette collaboration entre IRB Barcelona, CIBERER, IBMB-CSIC et le Centre de calcul intensif de Barcelone, les chercheurs ont caractérisé la structure du BasC par cristallographie aux rayons X et à l'aide d'un anticorps dirigé contre ce transporteur. "Les anticorps BasC que nous avons développés constituent un excellent outil pour étudier la fonction de ce transporteur, " ajoute Palacin.
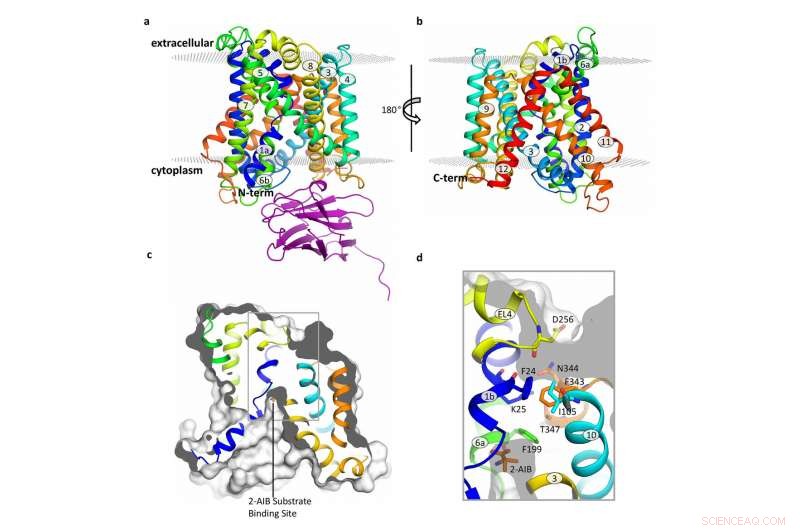
Structure du transporteur BasC. Crédit :Manuel Palacín, IRB Barcelone