
Les carbures métalliques bidimensionnels déclenchent une réaction qui divise l'eau en oxygène et en hydrogène gazeux précieux. Les chercheurs de Berkeley ont découvert une nouvelle recette facile pour préparer ces feuilles nanométriques qui est presque aussi simple que de faire du Jell-O à partir d'une boîte. Crédit :graphique Xining Zang, droit d'auteur Wiley
Un nouveau catalyseur bon marché et efficace développé par des chercheurs de l'Université de Californie, Berkeley, peut produire du carburant hydrogène à partir de l'eau aussi efficacement que le platine, actuellement le meilleur catalyseur de séparation de l'eau, mais aussi le plus cher.
Le catalyseur, qui est composé de feuilles nanométriques de carbure métallique, est fabriqué selon un procédé d'auto-assemblage qui repose sur un ingrédient surprenant :la gélatine, le matériau qui donne à Jell-O son agitation.
"Le platine est cher, il serait donc souhaitable de trouver d'autres matériaux alternatifs pour le remplacer, " a déclaré l'auteur principal Liwei Lin, professeur de génie mécanique à l'UC Berkeley. "Nous utilisons en fait quelque chose de similaire au Jell-O que vous pouvez manger comme base, et en le mélangeant avec certains des éléments abondants de la terre pour créer un nouveau matériau peu coûteux pour d'importantes réactions catalytiques. »
Le travail apparaît dans l'édition imprimée du 13 décembre de la revue Matériaux avancés .
Une décharge électrique peut briser les liens solides qui unissent les molécules d'eau, créer de l'oxygène et de l'hydrogène gazeux, ce dernier étant une source d'énergie extrêmement précieuse pour alimenter les piles à combustible à hydrogène. Le gaz hydrogène peut également être utilisé pour aider à stocker l'énergie provenant de sources d'énergie renouvelables mais intermittentes comme l'énergie solaire et éolienne, qui produisent un excès d'électricité quand le soleil brille ou quand le vent souffle, mais qui s'endorment les jours de pluie ou de calme.

Lorsqu'il est agrandi, les carbures métalliques bidimensionnels ressemblent à des feuilles de cellphane. Crédit :photo de Xining Zang, droit d'auteur Wiley
Mais le simple fait de coller une électrode dans un verre d'eau est une méthode extrêmement inefficace pour générer de l'hydrogène gazeux. Depuis 20 ans, les scientifiques ont recherché des catalyseurs capables d'accélérer cette réaction, ce qui le rend pratique pour une utilisation à grande échelle.
"La manière traditionnelle d'utiliser le gaz d'eau pour générer de l'hydrogène domine toujours dans l'industrie. Cependant, cette méthode produit du dioxyde de carbone comme sous-produit, " a déclaré le premier auteur Xining Zang, qui a mené la recherche en tant qu'étudiant diplômé en génie mécanique à l'UC Berkeley. "La production d'hydrogène électrocatalytique est en croissance au cours de la dernière décennie, suite à la demande mondiale de réduction des émissions. Le développement d'un catalyseur hautement efficace et peu coûteux pour l'électrohydrolyse apportera de profondes connaissances techniques, avantage économique et sociétal."
Pour créer le catalyseur, les chercheurs ont suivi une recette presque aussi simple que de faire du Jell-O à partir d'une boîte. Ils ont mélangé de la gélatine et un ion métallique, soit du molybdène, tungstène ou cobalt—avec de l'eau, puis laissez sécher le mélange.
"Nous pensons qu'à mesure que la gélatine sèche, il s'auto-assemble couche par couche, " dit Lin. " L'ion métallique est porté par la gélatine, alors quand la gélatine s'auto-assemble, votre ion métallique est également disposé dans ces couches plates, et ces feuilles plates sont ce qui donne à Jell-O sa surface caractéristique semblable à un miroir."
Le chauffage du mélange à 600 degrés Celsius déclenche la réaction de l'ion métallique avec les atomes de carbone de la gélatine, formant grand, feuilles nanométriques de carbure métallique. La gélatine n'ayant pas réagi brûle.
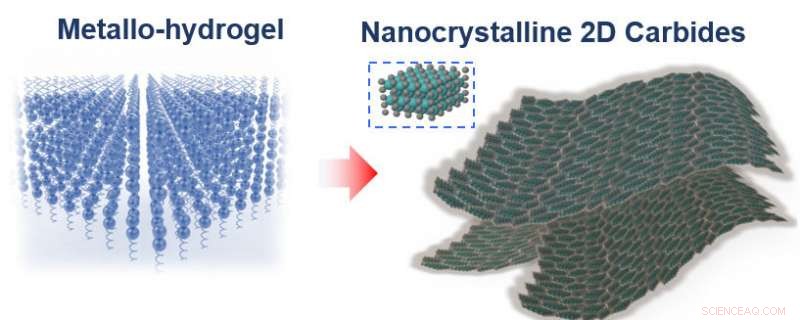
Les molécules en gélatine s'auto-assemblent naturellement en feuilles plates, transportant les ions métalliques avec eux (à gauche). Chauffer le mélange à 600 degrés Celsius brûle la gélatine, laissant des feuilles nanométriques de carbure métallique. Crédits :illustration de Xining Zang, droit d'auteur Wiley
Les chercheurs ont testé l'efficacité des catalyseurs en les plaçant dans de l'eau et en y faisant passer un courant électrique. Lorsqu'ils sont empilés les uns contre les autres, le carbure de molybdène fractionne l'eau de la manière la plus efficace, suivi du carbure de tungstène puis du carbure de cobalt, qui n'a pas formé de couches minces aussi bien que les deux autres. Le mélange d'ions molybdène avec une petite quantité de cobalt a encore amélioré les performances.
"Il est possible que d'autres formes de carbure offrent des performances encore meilleures, " dit Lin.
La forme bidimensionnelle du catalyseur est l'une des raisons de son succès. C'est parce que l'eau doit être en contact avec la surface du catalyseur pour faire son travail, et la grande surface des tôles signifie que les carbures métalliques sont extrêmement efficaces pour leur poids.
Parce que la recette est si simple, il pourrait facilement être mis à l'échelle pour produire de grandes quantités de catalyseur, disent les chercheurs.
"Nous avons constaté que les performances sont très proches du meilleur catalyseur composé de platine et de carbone, qui est l'étalon-or dans ce domaine, " dit Lin. "Cela signifie que nous pouvons remplacer le platine très cher par notre matériel, qui est fabriqué dans un processus de fabrication très évolutif."