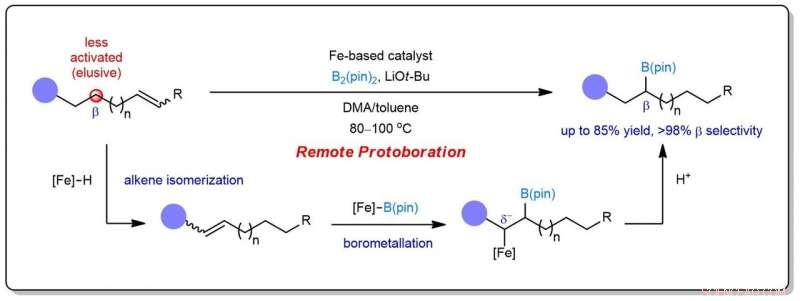
Figure 1 :Schéma montrant la conception de la protoboration à distance pour obtenir une borylation sélective à des positions moins activées. Crédit :Université nationale de Singapour
Les chimistes de l'Université nationale de Singapour ont découvert un moyen d'obtenir une borylation sélective des alcènes à l'aide de catalyseurs à base de fer abondants dans la terre pour faciliter la synthèse de produits chimiques de grande valeur.
En raison de leurs nombreux attributs souhaitables, les molécules contenant du bore jouent un rôle clé dans la découverte de médicaments et servent de précurseurs indispensables à divers produits chimiques allant des produits pharmaceutiques aux matériaux polymères. Dans ce contexte, une approche intéressante pour accéder aux composés organoborés aliphatiques implique l'hydroboration catalytique ou la protoboration de doubles liaisons carbone-carbone (C-C), réactions dans lesquelles de l'hydrogène et du bore sont tous deux ajoutés à un alcène. Une variante moderne de ce processus implique la borylation à distance, le bore étant inséré à distance du site réactif initial. Cependant, les méthodes existantes conduisent souvent à des borylations au terminus ou à des positions activées géminées (α) aux unités fonctionnelles. L'installation du groupe boryl tant convoité à des positions non activées est un formidable défi.
Une équipe de recherche dirigée par le professeur KOH Ming Joo, du Département de chimie, NUS a développé une nouvelle transformation catalytique connue sous le nom de protoboration à distance. Dans ce système, un seul complexe à base de fer favorise l'isomérisation des alcènes suivie d'un ajout sélectif de protoboryle à la liaison C=C. Ainsi, le bore peut être installé à des positions généralement moins activées proches (β) des groupes fonctionnels communs. Le protocole a une portée et une utilité importantes dans la synthèse de composés médicalement pertinents.
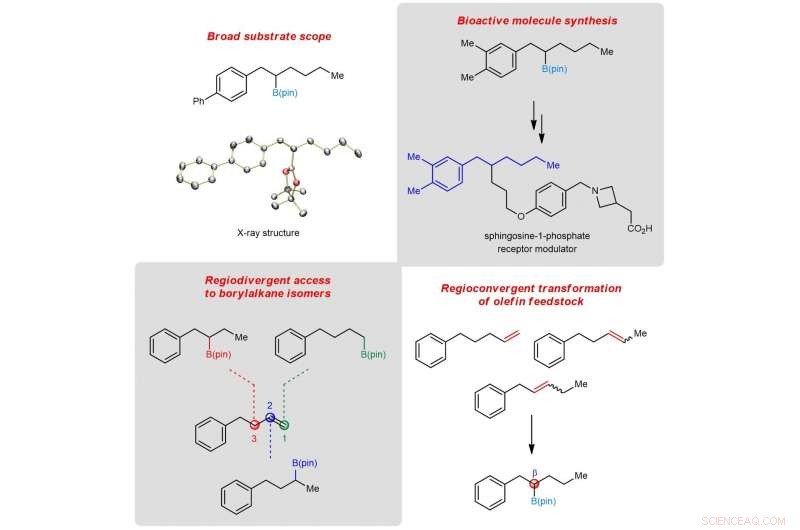
Figure 2 :Schéma montrant l'utilité de la borylation β-sélective dans la synthèse chimique et les réactions convergentes et divergentes régiosélectives. Crédit :Université nationale de Singapour
Des études mécanistiques détaillées ont révélé que le succès de la protoboration à distance réside dans la génération in situ de deux espèces organorides catalytiques (hydrure de fer et fer-boryl) qui fonctionnent en synergie. En s'appuyant sur ces informations, l'équipe a démontré que des mélanges de régioisomères alcènes (dans une matière première chimique non raffinée) peuvent être convertis en un seul produit, et un accès sélectif aux régioisomères de borylalcane à partir d'un substrat alcène peut être réalisé.
Le professeur Koh a dit, "Les deux intermédiaires catalytiques organoiron possèdent des profils de réactivité différents, leur permettant de coexister et de réagir de manière sélective. Un facteur de contrôle clé est la quantité de source de protons présente, soit généré de manière fortuite in situ, soit ajouté de manière exogène au mélange réactionnel. Cela aide à ajuster les taux relatifs d'isomérisation et de protoboration des alcènes."
"Cette découverte a d'énormes implications au-delà de la protoboration à distance. Si nous pouvons manipuler avec précision la position des changements d'alcène et l'insertion ultérieure de proto-boryle, nous pouvons potentiellement installer du bore à n'importe quel endroit souhaité d'une molécule organique. Les enseignements tirés de nos études devraient faire progresser les efforts généraux vers cet objectif ultime, " a ajouté le professeur Koh.
L'équipe de recherche prévoit d'appliquer les nouveaux concepts pour relever d'autres défis relatifs aux fonctionnalisations sélectives de sites de molécules organiques pour la synthèse de composés d'intérêt importants.