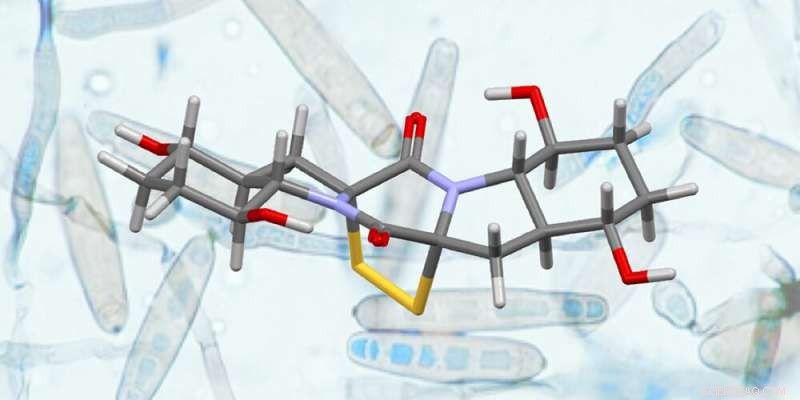
Structure de la rostratine A (premier plan) et du champignon « exserohilum rostratum » dont elle a été isolée (arrière-plan). Crédit :Université de Bâle, Olivier Baudoin avec Erlaubnis de G. Roberts
Des chimistes de l'Université de Bâle ont réussi à synthétiser deux produits naturels complexes du groupe des dithiodiketopipérazines (DTP). Pour ça, ils ont utilisé une nouvelle stratégie basée sur « l'activation des liaisons C-H, " résultant en un itinéraire court et à haut rendement. Dans l'édition la plus récente du Journal de l'American Chemical Society , les chercheurs décrivent leur nouveau concept de synthèse totale d'Epicoccin G et de Rostratine A.
Certains micro-organismes, comme les champignons, sont une riche source de métabolites secondaires, qui ont un grand potentiel dans les applications médicinales. Parmi ces métabolites secondaires, les dithiodicétopipérazines (DTP) présentent un intérêt particulier. car ils possèdent une variété d'activités biologiques intéressantes qui pourraient être utilisées dans le développement de nouveaux médicaments contre le paludisme ou le cancer. Cependant, malgré les efforts considérables déployés au cours de la dernière décennie, relativement peu de synthèses totales de ces molécules ont été réalisées et l'obtention des quantités nécessaires pour une enquête plus approfondie reste un objectif difficile.
Le professeur Olivier Baudoin et le premier auteur Pierre Thesmar du Département de chimie de l'Université de Bâle ont maintenant réussi à développer une synthèse efficace et évolutive de deux de ces produits naturels structurellement difficiles.
Activation des obligations C–H comme nouvelle stratégie synthétique
La voie de synthèse utilisée par l'équipe de Bâle a utilisé une nouvelle stratégie pour la construction du système d'anneaux impliquant une méthode connue sous le nom d'« activation de liaison C-H, " qui est devenu ces dernières années un outil de synthèse précieux. Dans cette étape clé, deux cycles sont formés simultanément par une double réaction dans laquelle une liaison carbone-hydrogène (liaison C-H) est clivée et une liaison carbone-carbone (liaison C-C) formée. Cette voie permet un accès efficace à un intermédiaire commun sur des quantités multigrammes à partir de peu de frais, matières premières disponibles dans le commerce.
Cet intermédiaire a ensuite été converti en premier DTP naturel, Épicoccine G, en sept étapes supplémentaires. Par rapport à la précédente synthèse totale unique de la même molécule, la synthèse actuelle affiche 14 pas au lieu de 17, et un rendement global beaucoup plus élevé de 19,6 pour cent au lieu de 1,5 pour cent.
Prochain défi :Rostratine A
Suite à la synthèse réussie d'Epicoccin G, l'équipe de recherche s'est aventurée à synthétiser la Rostratine A, une PAO naturelle connexe, pour la première fois et à plus grande échelle. Cette molécule présente un certain nombre d'éléments structurels intimidants qui ont nécessité une adaptation importante de la phase finale de la synthèse. Après de nombreuses expérimentations, optimisation de chaque étape et validation sur des grandeurs multigrammes, La rostratine A a été synthétisée sur une échelle de 500 mg. Globalement, cette synthèse totale a été réalisée en 17 étapes et avec un rendement global élevé de 12,7 pour cent.
La nouvelle stratégie révèle le potentiel élevé de la méthode d'activation des liaisons C-H dans le domaine de la synthèse de produits naturels. Dans une prochaine étape, les chercheurs visent à synthétiser d'autres DTC naturels et leurs analogues afin de mener des études plus avancées et d'évaluer davantage le potentiel médicinal.