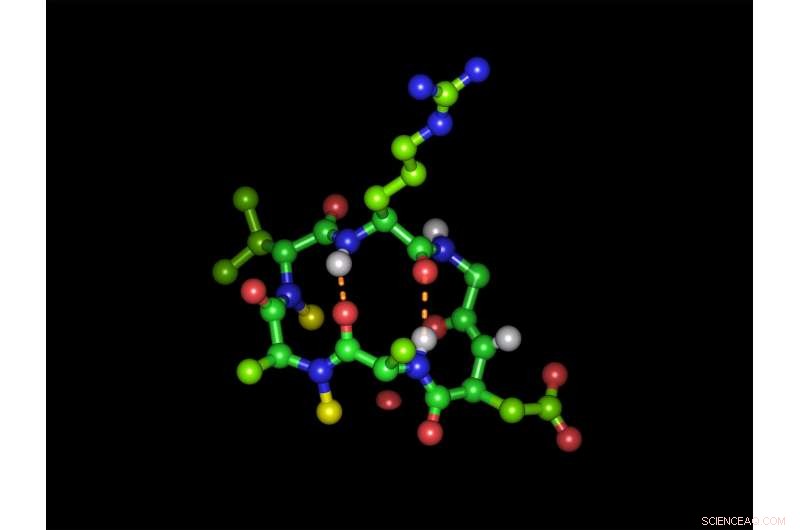
Hexapeptide cyclique sous sa forme bioactive avec la séquence tripeptide liant l'intégrine arginine-glycine-acide aspartique :les sphères vertes représentent les atomes de carbone, atomes d'oxygène rouge, atomes d'azote bleus et atomes d'hydrogène blancs. Les sphères jaunes représentent les deux groupes N-méthyle et les lignes oranges pointillées montrent les deux liaisons hydrogène intramoléculaires. Disposition (dans le sens des aiguilles d'une montre) :arginine (en haut), glycine, l'acide aspartique, alanine, alanine N-méthylée, D-valine N-méthylée. Crédit :Michael Weinmueller / TUM
Peptides, de courtes chaînes d'acides aminés qui contrôlent de nombreuses fonctions du corps humain, représentent un marché d'un milliard de dollars. Mais normalement, des médicaments à base de peptides doivent être injectés. Une équipe de recherche dirigée par l'Université technique de Munich (TUM) a maintenant déterminé comment les peptides peuvent être conçus pour être administrés sous forme de liquide ou de comprimé.
Les peptides sont de courtes chaînes d'acides aminés. Dans le corps humain, ils contrôlent diverses fonctions en tant que molécules de signalisation. Des exemples bien connus incluent l'insuline, qui comprend 51 éléments constitutifs d'acides aminés et contrôle le métabolisme du sucre, ou ciclosporine, un peptide de onze acides aminés dont il a été prouvé qu'il supprime le rejet d'organe après une greffe.
"Les peptides sont merveilleusement bien adaptés comme médicaments, " dit Horst Kessler, Carl von Linde Professeur à l'Institute for Advanced Study de la TU Munich. "Le corps les utilise déjà comme molécules de signalisation, et quand ils ont fait leur travail, ils peuvent être recyclés par le corps - pas d'accumulation, pas de désintoxication compliquée."
À l'échelle mondiale, il y a actuellement quelque 500 médicaments à base de peptides en essais cliniques. Une poignée de médicaments peptidiques génèrent déjà des milliards de revenus. Mais le fait qu'ils ne puissent pas être administrés sous forme de comprimés est un inconvénient décisif de presque toutes les substances de cette catégorie. Étant donné que les protéines sont une partie importante de l'alimentation, l'estomac et les intestins abritent d'innombrables enzymes qui brisent les liaisons peptidiques. Aucun médicament à base de peptides non modifiés n'aurait une chance de survivre au passage dans le tractus gastro-intestinal.
Pourtant, même lorsque les composés peptidiques modifiés de manière appropriée parviennent intacts à travers l'estomac, un autre obstacle les attend :les cellules des parois intestinales empêchent leur absorption dans le sang. C'est pourquoi ces types d'agents actifs ne sont généralement administrés que par injection. L'équipe a initialement abordé ces défis en utilisant un peptide modèle en forme d'anneau. Il comprenait six molécules de l'acide aminé le plus simple, alanine. Les scientifiques l'ont utilisé pour étudier l'effet du remplacement des atomes d'hydrogène des liaisons peptidiques par des groupes méthyle sur la disponibilité orale.
Cela a donné lieu à plus de 50 variantes. Des tests cellulaires effectués par des partenaires de collaboration en Israël ont montré que seules des variantes peptidiques spécifiques sont absorbées très rapidement. « Il apparaît que les hexapeptides cycliques à structure spécifique sont capables d'utiliser un système de transport existant, " explique le professeur Kessler. L'équipe a choisi des récepteurs d'intégrine qui contrôlent une variété de fonctions à la surface cellulaire comme cible pour leurs peptides. Une séquence des trois acides aminés arginine, la glycine et l'acide aspartique sont la clé de l'amarrage à ces récepteurs. Les collègues de Kessler ont incorporé la séquence clé à différentes positions de leur peptide modèle, créant ainsi de nouvelles variantes.
Cependant, à la fois la chaîne latérale chargée négativement de l'acide aspartique et l'arginine chargée positivement se sont avérées être des critères de désactivation pour l'utilisation du système de transport. L'équipe a néanmoins réussi à masquer les groupes chargés des deux acides aminés avec des groupes protecteurs. Bien qu'avec cela, le peptide perd initialement sa capacité à se lier à la molécule cible, si les bons groupes de protection sont sélectionnés, ils sont à nouveau séparés par des enzymes omniprésentes dans le sang. L'effet pharmaceutique est ainsi restauré à l'arrivée à destination.

Coauteurs Dr Florian Reichart, Dr Andreas Räder, Michael Weinmueller et le professeur Horst Kessler (fltr) dans le laboratoire de l'Université technique de Munich. Crédit :Uli Benz / TUM
Preuve de disponibilité orale
Des tests cellulaires ont montré que le nouvel hexapeptide a effectivement un effet biologique. A faible dose, il stimule la croissance des vaisseaux sanguins. Lorsque les souris sont nourries avec l'hexapeptide masqué, l'effet est le même que dans ceux qui ont été injectés avec l'hexapeptide non masqué. "Autrefois, les experts ont désigné la disponibilité orale des médicaments à base de peptides comme le « Saint Graal de la chimie des peptides ». Notre travail fournit une stratégie pour résoudre les défis de la stabilité, absorption dans l'organisme et efficacité biologique, " dit Kessler. " A l'avenir, cela simplifiera grandement la création de médicaments peptidiques qui peuvent être facilement administrés sous forme de liquide ou de comprimés."
La communication entre les cellules d'un corps dans les différents organes est un préalable essentiel à l'existence d'organismes multicellulaires. Récepteurs à la surface des cellules, les soi-disant intégrines, jouent ici un rôle important. Ils transmettent des informations sur l'environnement d'une cellule à l'intérieur de la cellule.
Tumeurs, par exemple, envoyer des signaux de croissance aux cellules des vaisseaux sanguins pour les maintenir en croissance et ainsi sécuriser l'approvisionnement en sang de la tumeur. En outre, les intégrines défectueuses sont à l'origine de nombreuses maladies, ce qui les rend très intéressantes pour les chercheurs pharmaceutiques.
Le rôle de la séquence de reconnaissance
Sur les 24 intégrines humaines, huit sous-types reconnaissent une petite séquence comprenant seulement trois acides aminés :arginine, glycine, et l'acide aspartique (abréviation :Arg-Gly-Asp, acronyme :RGD).
Cette structure s'insère dans le récepteur de l'intégrine comme une clé. Les molécules de signal et les protéines qui ont cette séquence déclenchent une réaction de la cellule. Avec d'autres acides aminés qui jouent un rôle de reconnaissance, la structure spatiale de la séquence détermine à laquelle des intégrines la clé correspond.
Les chercheurs pharmaceutiques sont maintenant à la recherche de molécules possédant ces séquences de reconnaissance dans la structure spatiale appropriée, leur permettant de déclencher les mêmes réactions cellulaires. La capacité de cibler spécifiquement différents sous-types d'intégrines est une étape importante vers une médecine personnalisée dans laquelle tous les types de cancer peuvent être combattus sur une base spécifique au patient.