Structure du récepteur Smoothened humain multi-domaines, une cible médicamenteuse importante pour les cancers. Crédit :Université de technologie de Shanghai
Une équipe de scientifiques dirigée par l'Institut iHuman de l'Université de ShanghaiTech en collaboration avec l'Université de Fudan a déterminé la structure cristalline à haute résolution du récepteur humain lissé à plusieurs domaines. Les résultats illustrent les interactions domaine-domaine allostériques au sein du récepteur, et leur rôle dans l'activation lissée. Ces nouvelles découvertes sont publiées le 17 mai, 2017 en Communication Nature , intitulé "Structure cristalline d'un récepteur lissé humain multi-domaines en complexe avec un ligand super stabilisant, " par Zhang X-J et al.
En tant qu'acteur central de la voie de signalisation Hedgehog impliquée dans le développement embryonnaire et la tumorigenèse, le récepteur lissé (SMO) a été longtemps recherché comme cible médicamenteuse pour de nombreux cancers. La résistance aux médicaments a cependant été un problème en raison de mutations dans SMO. "Le développement de médicaments anti-SMO de nouvelle génération sera facilité par la compréhension de l'arrangement multi-domaines dans la structure SMO", dit Fei Xu, Professeur assistant à l'Institut iHuman, Université de technologie de Shanghai, et le principal auteur correspondant de cet article. "Cette structure nous permettra d'identifier potentiellement de nouveaux sites de liaison de ligands et des mécanismes de signalisation."
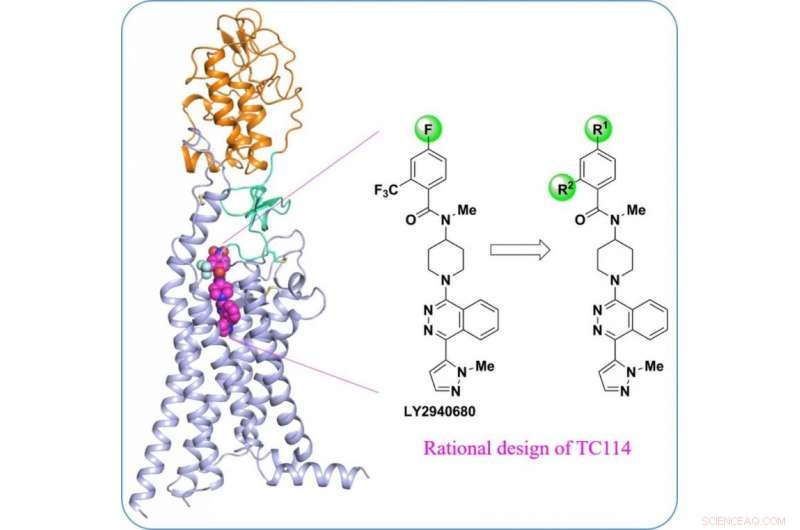
"Pour stabiliser la protéine SMO humaine multi-domaines, nous avons conçu une série de composés d'outils chimiques", dit Houchao Tao, Professeur agrégé de recherche à l'Institut iHuman. « TC114 est une sonde qui stabilise et verrouille de manière significative le récepteur dans une seule conformation. » Avec une optimisation supplémentaire, Le doctorant Xianjun Zhang a résolu la structure SMO multidomaine liée au TC114 à 2,9 angströms à l'aide d'un laser à électrons libres à rayons X. "Cette structure révèle le domaine charnière qui peut jouer un rôle modulateur important dans la connexion des domaines, fournissant des pistes pour le développement de nouveaux modulateurs ciblant cette région", dit Xianjun Zhang.
"C'est un beau travail d'équipe", dit Raymond Stevens, Directeur de l'Institut iHuman, Université de technologie de Shanghai, "La chimie et la biologie sont reliées dans cette science pour comprendre la structure et la fonction de ce récepteur multidomaine complexe. La structure cristalline, à son tour, ouvre de nouvelles voies pour la découverte de médicaments."