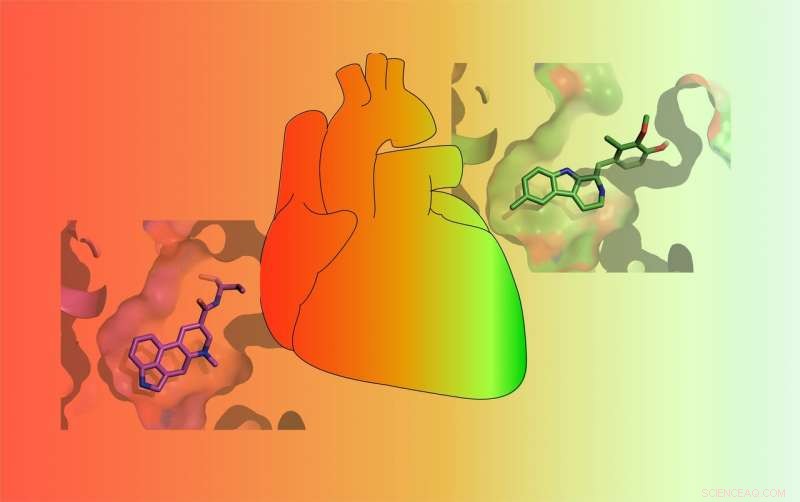
Les médicaments varient dans leur capacité à activer le récepteur de la sérotonine 5-HT2B. Certains médicaments (RED) activent fortement le récepteur et provoquent une cardiopathie valvulaire potentiellement mortelle, tandis que d'autres ne l'activent que faiblement (VERT) et sont moins susceptibles de provoquer des effets secondaires graves. Crédit :Roth Lab
Sérotonine, connu sous le nom de neurotransmetteur du « bonheur », est un produit chimique présent dans le corps et responsable des sensations de bien-être. Mais la sérotonine n'est pas la seule substance chimique qui se lie aux 13 récepteurs de la sérotonine présents à la surface des cellules. Loin de là. De nombreux médicaments approuvés se lient également aux récepteurs de la sérotonine. Et l'un de ces récepteurs, appelé 5-HT2BR, a rendu les développeurs de médicaments très mécontents. C'est parce que certains médicaments qui traitent la maladie de Parkinson, migraine, tumeurs hypophysaires, et l'obésité ont été conçus pour cibler d'autres récepteurs cellulaires mais également activer le 5-HT2BR, conduisant à une cardiopathie valvulaire potentiellement mortelle. Par conséquent, bon nombre de ces médicaments ont été retirés du marché.
Maintenant, pour la première fois, Les scientifiques de l'UNC School of Medicine ont compris précisément pourquoi un médicament se lie au 5-HT2BR et active le récepteur pour provoquer des problèmes cardiaques alors que des médicaments très similaires ne le font pas. Ils ont également découvert pourquoi une troisième drogue agit comme un antagoniste 5-HT2BR – elle bloque l'activité du récepteur – alors que la drogue hallucinogène similaire très connue, le LSD, ne le fait pas.
Publié dans Nature Biologie structurale et moléculaire , cette recherche fournit aux développeurs de médicaments des informations indispensables sur ce récepteur de la sérotonine et d'autres similaires.
"Pendant longtemps, nous avons eu besoin de savoir précisément comment ce récepteur et d'autres se lient à divers composés si nous voulons concevoir des médicaments plus sûrs et plus efficaces, " a déclaré l'auteur principal Bryan L. Roth, MARYLAND, Doctorat., le professeur émérite Michael Hooker de thérapie protéique et de protéomique translationnelle au département de pharmacologie. "Résoudre les structures cristallines de ces récepteurs de la sérotonine liés à plusieurs composés est la première étape essentielle nécessaire pour créer de meilleurs médicaments, non seulement pour les conditions susmentionnées, mais pour de nombreuses autres, y compris la schizophrénie, anxiété, et la dépression."
Dans les expériences menées par John McCorvy, Doctorat., qui était stagiaire postdoctoral au laboratoire Roth pendant cette recherche, les scientifiques ont laborieusement induit les récepteurs à se condenser en un réseau cristallin serré tandis que les récepteurs étaient attachés à un médicament. Ensuite, ils ont projeté des rayons X sur le cristal pour calculer la structure du récepteur à partir des diagrammes de diffraction résultants. McCorvy et ses collègues l'ont fait plusieurs fois pour cristalliser les récepteurs de la sérotonine liés à plusieurs composés différents, qui avait été impossible pendant des décennies parce que les récepteurs sont des protéines notoirement inconstantes - petites, fragile, et généralement en mouvement lorsqu'ils se lient aux composés.
Les scientifiques ont ensuite utilisé d'autres techniques expérimentales décrites dans l'article pour montrer précisément comment chaque médicament activait ou n'activait pas le récepteur.
Dans une série d'expériences, McCorvy et ses collègues ont montré que la méthylergonovine, l'ingrédient actif d'un médicament contre la migraine, se lie à une région particulière de 5-HT2BR et l'active. La méthylergonovine est un agoniste. Mais son composé parent, méthysergide, n'active pas le récepteur, ce qui en fait un antagoniste. Le laboratoire de Roth a découvert que la différence entre les deux médicaments n'est qu'un atome de carbone et quelques atomes d'hydrogène. Ensemble, ils s'appellent un méthyle. Ce petit méthyle s'avère être le coupable des problèmes de valves cardiaques liés au 5-HT2BR.
Dans une deuxième série d'expériences, ils ont montré pourquoi le lisuride, un médicament contre la maladie de Parkinson, n'active pas le 5-HT2BR alors que le LSD le fait. La différence au niveau du site de liaison n'est qu'un seul atome d'azote et une stéréochimie - essentiellement l'espace entre le médicament et le récepteur qui joue un rôle dans la précision avec laquelle un médicament peut s'insérer dans le récepteur pour déclencher ou arrêter l'activité cellulaire.
De façon intéressante, le lisuride et le LSD se lient au récepteur de la sérotonine dans la région typique à laquelle les scientifiques s'attendent. Mais la chimie de la façon dont ces deux médicaments se lient à ce site n'explique pas leurs effets très différents sur les cellules et les personnes. McCorvy et ses collègues ont découvert que le lisuride est également coincé dans une autre partie du récepteur appelée poche de liaison étendue, mais le contact du lisuride n'est pas fort. Le LSD, par contre, se lie fortement à la poche de reliure étendue, faisant du LSD un agoniste très puissant, il active le 5-HT2BR (ainsi que d'autres récepteurs). Le LSD le fait en recrutant une protéine appelée bêta-arrestine2. Les scientifiques appellent ce processus "l'activation de la voie de la β-arrestine, " et il a été impliqué dans divers effets secondaires liés à la thérapeutique.
Ces résultats aideront les concepteurs de médicaments à éviter d'activer le 5-HT2BR lors de la conception de médicaments pour cibler d'autres protéines réceptrices, communément appelées récepteurs couplés aux protéines G, ou GPCR. Inversement, cette recherche aidera les développeurs de médicaments qui souhaitent inhiber l'activation du 5-HT2BR pour traiter les cardiopathies valvulaires et d'autres troubles.
"Essentiellement, en cristallisant les structures du 5-HT2BR liées à plusieurs médicaments courants, nous avons découvert qu'il n'y a pas de mécanisme par lequel le récepteur est activé, " a déclaré McCorvy. " Il y en a plusieurs. " Pour créer un en sécurité, et des médicaments efficaces, les scientifiques veulent exploiter uniquement les voies cellulaires importantes pour traiter la maladie qui les intéresse. McCorvy a ajouté, "C'est la pointe du développement de médicaments."