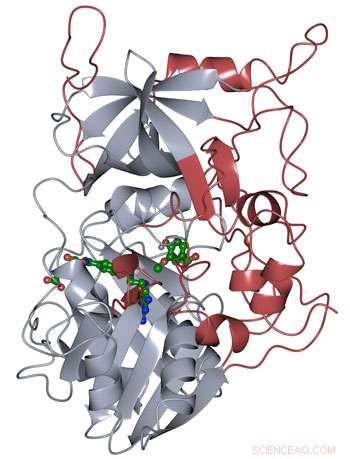
La structure protéique de LigM a été déterminée par cristallographie aux rayons X, révélant de nouveaux éléments structuraux uniques à LigM (rouge) en plus d'un domaine de liaison au tétrahydrofolate conservé (gris) que l'on trouve tout au long de la vie. LigM se lie à ses substrats (vert) en utilisant des cavités de liaison internes. Crédit :Amanda Kohler/JBEI
Une protéine utilisée par les bactéries du sol communes fournit de nouveaux indices dans l'effort pour convertir les composés aryles, un déchet commun des pratiques industrielles et agricoles, en quelque chose de valeur.
Des chercheurs du Lawrence Berkeley National Laboratory (Berkeley Lab) du Department of Energy et des Sandia National Laboratories travaillant au Joint BioEnergy Institute (JBEI) ont résolu la structure protéique de l'enzyme LigM, qui est utilisé par la bactérie du sol Sphingomonas pour métaboliser les composés aryles dérivés de la lignine, le raide, matière organique qui donne aux plantes leur structure.
Leurs travaux sont rapportés aujourd'hui dans le Actes de l'Académie nationale des sciences .
Dans la production de biocarburants, les composés aryles sont un sous-produit de la dégradation de la lignine. De nombreuses voies conduisant à la dégradation de la lignine impliquent la déméthylation, qui est souvent un précurseur critique de toute étape supplémentaire de modification des composés aryles dérivés de la lignine.
L'auteur principal de l'étude Amanda Kohler, Chercheur postdoctoral JBEI à Sandia, a noté que LigM est une déméthylase intéressante pour une utilisation dans la conversion aromatique car il s'agit d'un simple, système à une seule enzyme. LigM est également capable de maintenir sa fonctionnalité sur une large plage de températures.
"Quand nous essayons de construire de nouvelles voies en biologie synthétique, plus le système est simple, mieux c'est, " dit Kohler.

La chercheuse postdoctorale Amanda Kohler met en place des réactions enzymatiques dans le cadre de l'Enzyme Optimization Group de JBEI. Crédit :Marilyn Chung/Berkeley Lab
Les chercheurs ont découvert que la moitié de l'enzyme LigM était homologue à des structures connues avec un domaine de liaison au tétrahydrofolate que l'on trouve aussi bien dans des organismes simples que complexes. L'autre moitié de la structure de LigM est totalement unique, fournissant un point de départ pour déterminer où se trouve son site de liaison au substrat aryle. Ils ont également découvert que LigM est une déméthylase dépendante de la tyrosine.
"C'est le premier du genre à être identifié, " a déclaré Kohler. "Cette recherche fournit les bases indispensables pour aider au développement d'un système à base d'enzymes pour convertir les déchets aromatiques en quelque chose d'utile."
Kohler a déclaré qu'ils travaillaient maintenant sur l'ingénierie du LigM afin qu'il soit capable d'agir sur une plus large gamme de substrats aryles en plus de cibler des déchets aryliques spécifiques.