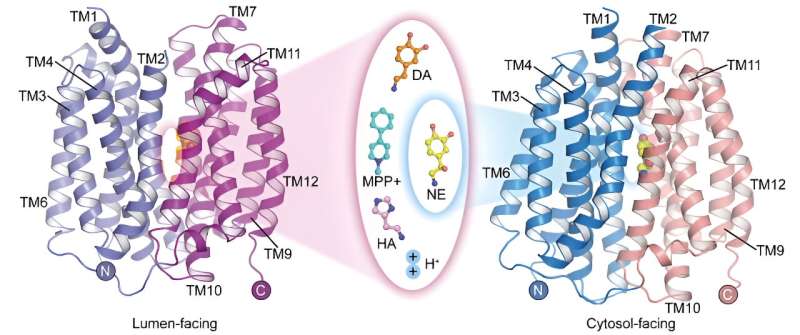
Le transporteur vésiculaire de monoamine 2 (VMAT2) est la seule protéine de transport du système nerveux central qui assure le stockage des neurotransmetteurs monoamines. Il joue un rôle essentiel dans la médiation de la transmission de l'influx nerveux et de la neuroprotection.
Actuellement, les mécanismes par lesquels VMAT2 reconnaît et transporte plusieurs neurotransmetteurs monoamines structurellement différents et l'inducteur de la maladie de Parkinson MPP + ne sont pas clairs, et le mécanisme moléculaire du transport du substrat couplé aux protons doit également être exploré plus en détail.
Dans une étude publiée dans Cell Research le 22 mai, une équipe de recherche dirigée par le professeur Zhao Yan de l'Institut de biophysique de l'Académie chinoise des sciences (CAS), en collaboration avec le professeur Jiang Daohua de l'Institut de physique de CAS, a rapporté la structure apo de l'humain. transporteur vésiculaire de monoamine 2 (hVMAT2) à faible pH, les structures complexes des vésicules face à la dopamine, à la noradrénaline, à l'histamine et à la neurotoxine MPP + liaison et la structure complexe de la liaison de la noradrénaline dans l'état face au cytosol.
Ces structures révèlent la base structurelle de la reconnaissance du substrat VMAT2 et affinent davantage le mécanisme moléculaire du transport du substrat couplé aux protons.
Bien que la norépinéphrine, la dopamine, la sérotonine et le MPP + ont des structures moléculaires différentes, les structures complexes de liaison de VMAT2 à ces substrats montrent qu'elles se lient toutes à des positions similaires sur la protéine transporteuse. Cependant, des différences subtiles dans certains groupes fonctionnels de ces substrats conduisent à des différences significatives et critiques dans leurs interactions et leurs modes de liaison avec la protéine transporteuse. Ces différences illustrent comment VMAT2 reconnaît efficacement différentes molécules de substrat.
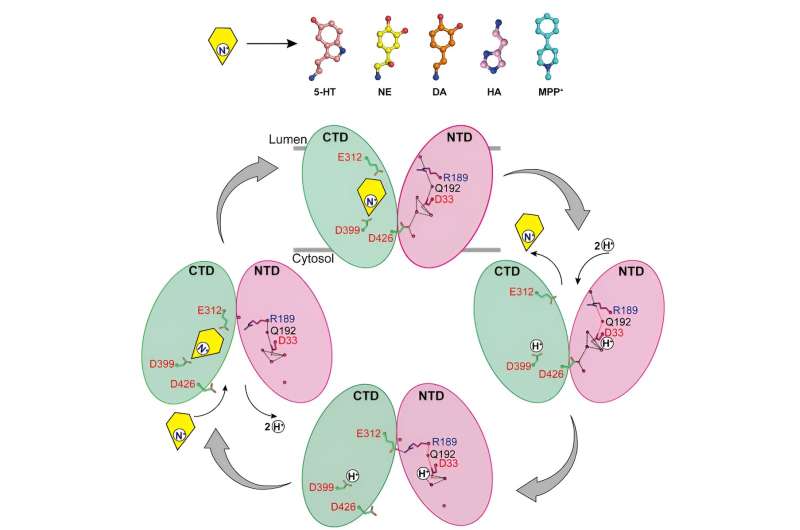
Les chercheurs ont rapporté les structures de liaison de la noradrénaline à VMAT2 dans différentes conformations, y compris les conformations faisant face au cytosol et aux vésicules.
Malgré des changements conformationnels importants dans VMAT2, la poche de liaison au substrat pour la noradrénaline reste relativement stable au cours de ce processus, sans changement significatif dans les interactions avec les résidus environnants. Cette transition conformationnelle intelligente est cruciale pour le fonctionnement de VMAT2.
En analysant les structures de VMAT2 dans différentes conditions de pH, il a été confirmé que D33 pourrait être un autre site clé de protonation.
En analysant minutieusement les mécanismes par lesquels VMAT2 reconnaît différents neurotransmetteurs monoamines et neurotoxines structurellement divers, ce travail propose un modèle moléculaire pour les changements conformationnels de VMAT2 et affine davantage le mécanisme spécifique du transport de substrat couplé à des protons.
Ces résultats fournissent des informations précieuses pour une compréhension globale du mode de transport VMAT2, enrichissent le système de connaissances sur le transport des substrats de la super-famille des facilitateurs majeurs et posent une base importante pour le développement et l'optimisation de médicaments.
Plus d'informations : Di Wu et al, Des instantanés structurels du VMAT2 humain révèlent des informations sur la reconnaissance du substrat et le mécanisme de couplage des protons, Cell Research (2024). DOI :10.1038/s41422-024-00974-9
Informations sur le journal : Recherche cellulaire
Fourni par l'Académie chinoise des sciences