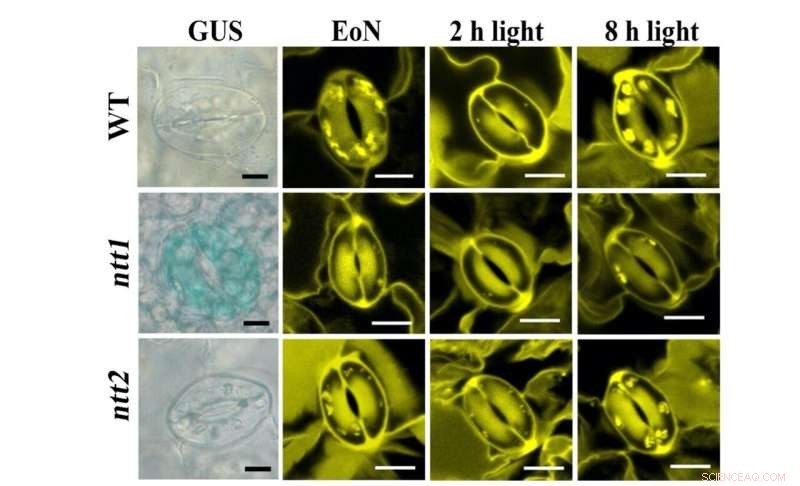
Figure 1 :Coloration des transporteurs NTT (bleu, panneau de gauche) et des granules d'amidon (jaune, panneau de droite) dans les GC. Crédit :Université de Hong Kong
La question de savoir si les cellules de garde (GC) réalisent la photosynthèse fait l'objet de débats depuis des décennies. Des études antérieures ont suggéré que les chloroplastes des cellules de garde (GCC) ne peuvent pas fixer le CO2 mais des études ultérieures ont soutenu le contraire. Jusqu'à récemment, il restait controversé de savoir si les GCC et/ou la photosynthèse GC jouaient un rôle direct dans les mouvements stomatiques. Le Dr Boon Leong LIM, professeur associé à la School of Biological Sciences de l'Université de Hong Kong (HKU), en collaboration avec le Dr Diana SANTELIA de l'ETH Zürich, a découvert la véritable source de carburant des GC et a percé le mystère. Les résultats ont été récemment publiés dans la prestigieuse revue Nature Communications .
Le matin, la lumière du soleil déclenche l'ouverture des stomates, qui sont de minuscules pores sur les feuilles des plantes. Cela laisse CO2 dans et O2 pour booster la photosynthèse. L'ouverture des stomates consomme une grande quantité d'adénosine triphosphate (ATP), la monnaie énergétique cellulaire, mais les sources d'ATP pour l'ouverture des stomates sont restées obscures. Certaines études ont suggéré que les GCC effectuent la photosynthèse et exportent l'ATP vers le cytosol pour dynamiser l'ouverture des stomates. Dans les chloroplastes du mésophylle, l'ATP et le NADPH (nicotinamide-adénine dinucléotide phosphate) sont générés à partir de photosystèmes, qui sont utilisés comme carburant pour fixer le CO2 .
En utilisant des capteurs de protéines à fluorescence in planta, l'équipe du Dr Boon Leong Lim de HKU a pu visualiser la production en temps réel d'ATP et de NADPH dans les chloroplastes des cellules mésophylles (MCC) d'une plante modèle, Arabidopsis thaliana. "Cependant, nous n'avons pu détecter aucune production d'ATP ou de NADPH dans les GCC pendant l'illumination. Intrigués par cette observation inattendue, nous avons contacté une experte en métabolisme des cellules de garde, le Dr Diana Santelia de l'ETH Zürich, pour une collaboration", a déclaré le Dr Lim. Au cours de la dernière décennie, le laboratoire Santelia a fourni des informations approfondies et importantes sur le métabolisme de l'amidon et des sucres dans les cellules de garde (GC) entourant les pores stomatiques à la surface des feuilles.
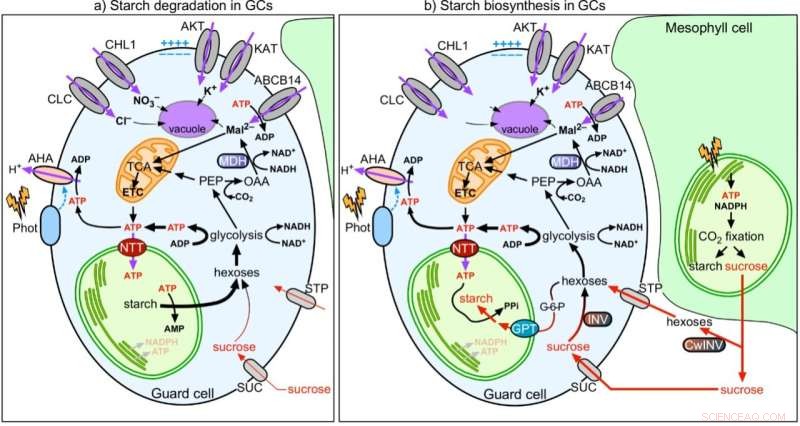
Figure 2 :Modèle de la coordination de la fonction stomatique avec le métabolisme de l'amidon et du malate dans les cellules de garde. Crédit :Université de Hong Kong
Dans des efforts conjoints, l'équipe montre que contrairement aux cellules mésophylles (MC), la photosynthèse GC est peu active. Les sucres synthétisés et fournis par les MC sont importés dans les GC et consommés par les mitochondries pour générer de l'ATP pour l'ouverture des stomates. Contrairement aux MCC, les GCC absorbent l'ATP cytosolique via les transporteurs de nucléotides (NTT) sur la membrane chloroplastique pour dynamiser la synthèse d'amidon pendant la journée. À l'aube, alors que les MC commencent à synthétiser l'amidon et à exporter du saccharose, les GC dégradent l'amidon en sucres pour fournir de l'énergie et augmenter la pression de turgescence pour l'ouverture des stomates. Par conséquent, la fonction des GCC de servir de réserve d'amidon est importante pour l'ouverture des stomates. Pendant que les MC corrigent le CO2 dans les chloroplastes via le cycle de Calvin-Benson-Bassham (CBB), CO2 la fixation dans le cytosol est la voie principale du CO2 l'assimilation dans les GC, où le malate produit en aval, est également un soluté important pour augmenter la pression de turgescence pour l'ouverture stomatique. En conclusion, les GC se comportent plus comme un puits (recevant des sucres) que comme un tissu source (fournissant des sucres). Leur fonction est étroitement corrélée à celle des MC pour coordonner efficacement le CO2 absorption via les stomates et le CO2 fixation dans les MC.
"J'étais très enthousiaste lorsque le Dr Lim m'a contacté pour me demander de collaborer à ce projet", a déclaré le Dr Diana Santelia. "Nous avons essayé de clarifier ces questions fondamentales en utilisant des approches de génétique moléculaire. Combiner nos expertises respectives a été une stratégie gagnante", a-t-elle poursuivi. Dr. Sheyli LIM, le premier auteur de l'article et ancien Ph.D. étudiant du groupe de Lim a fait remarquer "Les capteurs de protéines de fluorescence in planta que nous avons développés sont des outils puissants pour visualiser les changements dynamiques des concentrations de molécules d'énergie dans les cellules végétales individuelles et les organites, ce qui nous permet de résoudre certaines questions clés en bioénergétique végétale. Je suis heureux de publier nos découvertes dans Nature Communications en utilisant cette nouvelle technologie."