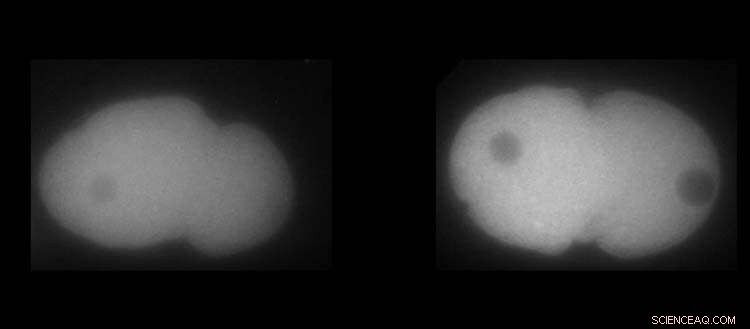
À gauche, protéine MEX-5. À droite, la protéine PLK-1 dans les embryons de C. elegans. Le blanc montre la présence plus ou moins importante des protéines. Crédit :UNIGE / Laboratoire Monica Gotta
Chacune de nos cellules contient environ 40 millions de protéines qui, ensemble, accomplissent toutes les tâches dont la cellule a besoin pour survivre. Pour une action en douceur, les bonnes protéines doivent être concentrées en quantités spécifiques, à un moment précis et à un endroit précis. Cependant, l'établissement d'une distribution aussi délicate nécessite un processus extrêmement précis, se produisant à de minuscules résolutions spatiales que les outils de biologie cellulaire standard sont souvent incapables de détecter. Pour comprendre le fonctionnement de ce mécanisme, des chercheurs de l'Université de Genève (UNIGE) ont développé une nouvelle approche combinant des expériences de génétique et de biologie cellulaire avec la modélisation physique. Grâce à des algorithmes spécifiques, ils ont simulé la formation de gradients protéiques en 3D et dans le temps et ont pu expliquer ces mécanismes complexes. De plus, leur modèle innovant peut être adapté à d'autres systèmes biologiques pour étudier la dynamique des protéines. Ces résultats peuvent être lus dans les Actes de l'Académie nationale des sciences .
Comme une goutte d'encre dans un verre d'eau, les protéines peuvent se diffuser et se répartir uniformément dans la cellule. Cependant, pour un certain nombre de tâches, les protéines doivent former des gradients. "Les gradients de protéines, qui résultent de la distribution inégale des protéines dans des zones cellulaires spécifiques, sont au cœur de nombreuses fonctions cellulaires et de l'organisme", explique Monica Gotta, professeur au Département de physiologie cellulaire et métabolisme et au Centre de recherche translationnelle en Onco- d'hématologie (CRTOH) de la Faculté de médecine de l'UNIGE, qui a dirigé ces travaux. "Par exemple, les gradients de protéines sont importants pour la différenciation cellulaire, le processus par lequel les différents types de cellules qui constituent un organisme complexe émergent d'une cellule unique, l'œuf fécondé."
Une utilisation du hasard
La protéine PLK-1, un régulateur clé de la division cellulaire, est connue pour être plus concentrée à la face antérieure de l'embryon. Mais comment mettre en place ce mécanisme, et quelle serait la conséquence si le moindre détail tournait mal ? Les outils habituels de la biologie n'étant pas suffisants pour répondre à cette question, Monica Gotta a été heureuse d'accueillir dans son équipe une physicienne, Sofia Barbieri, post-doctorante au Département de physiologie cellulaire et métabolisme de la Faculté de médecine de l'UNIGE.
"En compilant tout ce que l'on sait sur ce processus biologique et de nouvelles hypothèses sur les mécanismes, j'ai développé un modèle statistique de formation de gradients de protéines basé sur des mathématiques probabilistes", explique Sofia Barbieri. "J'ai eu recours à des algorithmes de calcul spécifiques, appelés simulations de Monte Carlo, du nom de la célèbre ville du jeu." Ces algorithmes sont utilisés pour modéliser des phénomènes très complexes, tels que la finance, le trading ou la physique des particules.
L'équipe a pu simuler des gradients de protéines, non seulement en 3D, mais aussi dans le temps. Un tel modèle a cependant nécessité plusieurs itérations entre l'optimisation des paramètres et la comparaison avec les données biologiques. Les chercheurs ont construit une première version du modèle intégrant tous les éléments physiques et biologiques connus du système, puis ont introduit des paramètres spécifiques nécessaires pour tester plusieurs hypothèses concernant les variables inconnues. Ils ont simulé les résultats physiques et biologiques possibles qui reproduisaient par calcul la dynamique des protéines et l'établissement du gradient dans la cellule, et les ont testés dans la vie réelle avec des expériences in vivo utilisant les embryons d'un petit ver, le nématode C. elegans.
Interactions protéiques complexes en jeu
Grâce à l'interaction continue entre la modélisation et la biologie cellulaire, les chercheurs de l'UNIGE ont pu déterminer comment le gradient de PLK-1 s'établissait et se maintenait dans le temps. En effet, PLK-1 doit se lier et se délier dynamiquement de MEX-5, une autre protéine cruciale pour le développement de l'embryon de C. elegans, pour contrecarrer sa tendance naturelle à se diffuser de manière homogène dans la cellule. MEX-5 a en effet la capacité de changer sa diffusivité en fonction de sa position dans la cellule et d'interagir avec d'autres protéines, ce qui est essentiel pour enrichir PLK-1 là où c'est nécessaire. "Mais de manière assez surprenante, MEX-5 n'est pas si efficace dans sa tâche, car une grande quantité de PLK-1 n'est pas liée à MEX-5", souligne Sofia Barbieri.
Cette étude fournit un modèle quantitatif unique pour comprendre les interactions dynamiques entre protéines et peut être adapté à d'autres cellules ou protéines dont les mécanismes complexes ne peuvent pas être testés avec les expériences habituelles de biologie cellulaire. "Nos travaux montrent que les collaborations interdisciplinaires sont de plus en plus importantes pour faire avancer la recherche", conclut Monica Gotta.