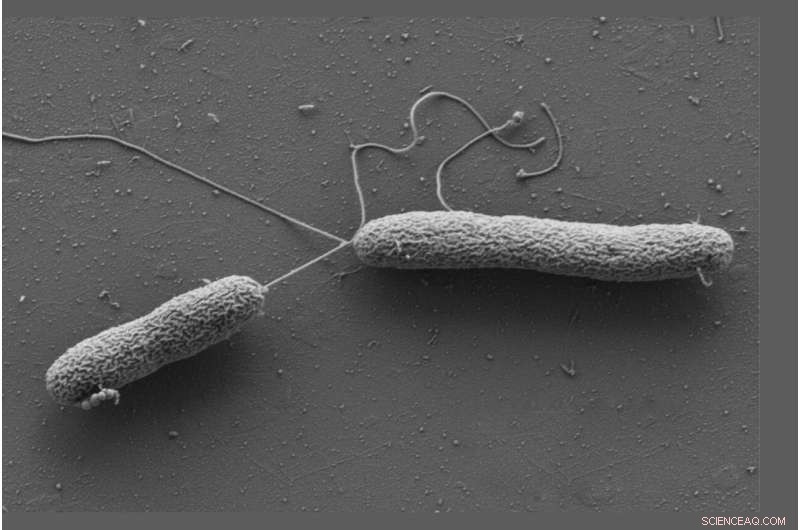
Cellules de Vibrio campbellii se déplaçant à l'aide de longs flagelles. Crédit :Wanner/Jung, LMU
Chez les humains et les animaux, les catécholamines telles que l'épinéphrine, la noradrénaline et la dopamine sont des hormones de stress courantes. Le stress peut augmenter la susceptibilité du corps aux infections bactériennes. En laboratoire, les hormones de stress stimulent la croissance de divers agents pathogènes. Cela avait déjà été observé chez Salmonella (Salmonella enterica serovar Typhimurium), et d'autres bactéries intestinales, Escherichia coli et l'agent causal du choléra, Vibrio cholerae. De plus, l'épinéphrine et la norépinéphrine facilitent l'infection des cellules du corps par les bactéries. Et ces hormones influencent également la biosynthèse des facteurs de virulence, qui permettent aux agents pathogènes d'adhérer, de pénétrer et de détruire les cellules.
"Nous avons donc soupçonné que certaines bactéries utilisent ces hormones comme signaux pour reconnaître l'environnement de l'hôte eucaryote", explique le professeur Kirsten Jung, microbiologiste au LMU. "Mais la base moléculaire n'était pas connue." Avec le professeur Stephan A. Sieber de l'Université technique de Munich (TUM) et d'autres chercheurs, Jung a maintenant identifié le site de liaison de l'épinéphrine et de la phényléphrine dérivée de l'épinéphrine dans la bactérie Vibrio campbellii. Comme le rapporte l'équipe dans PNAS , la cible des deux molécules est la protéine CheW. "La signification biologique du mécanisme est que les bactéries reconnaissent, par exemple, qu'elles ne sont plus dans l'eau de mer, mais dans l'intestin d'un hôte", explique Jung.
Études avec l'organisme modèle V. campbellii
"Nous voulions savoir comment les bactéries reconnaissent les catécholamines comme molécules de signalisation", explique le scientifique du LMU. « Quels récepteurs contrôlent ce processus ? » Ses expériences consistaient en plusieurs étapes individuelles.
Pour l'étude, Sieber a développé une méthode de modification chimique de l'épinéphrine et de la phényléphrine, afin que les chercheurs puissent directement isoler les complexes des catécholamines et des protéines bactériennes liées. Une condition préalable aux expériences était que les nouveaux composés n'auraient aucune caractéristique biologique que les molécules non modifiées n'avaient pas. Le groupe de Jung a fait des expériences en laboratoire pour démontrer qu'il en était ainsi. L'épinéphrine lie le fer, contrairement à la phényléphrine, un dérivé de l'épinéphrine. Avec leur choix de composés, les chercheurs ont voulu exclure les effets qui surviennent lorsque les bactéries ont un meilleur apport en fer.
Jung et Sieber ont travaillé avec Vibrio campbellii comme organisme modèle. La bactérie marine infecte les poissons, les crevettes, les calmars et de nombreux autres invertébrés marins. Ils ont ajouté Vibrio campbellii aux catécholamines modifiées chimiquement et ont lysé les cellules. Ensuite, ils ont extrait du lysat toutes les protéines auxquelles une molécule s'était liée et les ont caractérisées en utilisant l'analyse du protéome. Cela a entraîné un enrichissement particulier de la protéine de chimiotaxie soluble CheW.
Par la suite, le groupe de Jung a isolé la protéine CheW directement à partir de bactéries, l'a purifiée et a mesuré son affinité de liaison aux catécholamines. Dans le processus, les chercheurs ont découvert quelque chose de surprenant :les hormones ne se lient pas aux chimiorécepteurs eux-mêmes, comme prévu à l'origine, mais à la protéine de couplage CheW, qui se situe entre les récepteurs et une cascade de transduction du signal. L'ensemble de ce système de perception des stimuli contrôle le mouvement de la bactérie dans un gradient chimique.
"Notre étude apporte de nouvelles informations sur la communication des bactéries avec leur hôte", résume Jung. "Nous avons pu montrer que le comportement de nage des bactéries est modifié par les hormones de l'hôte, qui sont contrôlées par CheW." La motilité, et en particulier la motilité dirigée, est d'une importance décisive pour la colonisation de l'hôte, car les bactéries cherchent délibérément à coloniser un organisme et à conquérir toutes les niches. Dans la prochaine étape, Jung veut maintenant savoir si le même mécanisme peut être détecté dans d'autres bactéries.