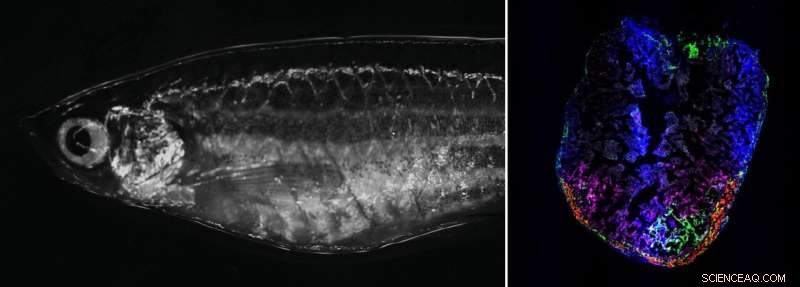
À droite :poisson zèbre adulte au microscope à fond clair. À gauche :cœur de poisson zèbre 7 jours après la cryolésion. Les fibroblastes activés de manière transitoire se localisent dans la zone de la blessure. Crédit :Laboratoire Panáková, MDC
Une équipe de recherche MDC dirigée par Jan Philipp Junker et Daniela Panáková a découvert que le poisson zèbre peut régénérer le tissu cardiaque après une blessure. Les cellules du tissu conjonctif jouent un rôle important dans le processus en entrant temporairement dans un état activé, comme le rapporte l'équipe dans Nature Genetics .
Lorsqu'une personne subit une crise cardiaque et ne reçoit pas de traitement assez rapidement, les cellules du muscle cardiaque (cardiomyocytes) sont endommagées par un manque d'oxygène et commencent à mourir. Du tissu cicatriciel se forme alors, et comme nous ne pouvons pas produire de nouveaux cardiomyocytes, le cœur ne peut plus pomper aussi bien qu'il le devrait. Les choses sont très différentes chez les vertébrés inférieurs comme le poisson zèbre, qui peut régénérer des organes, y compris son cœur.
"Nous voulions savoir comment ce petit poisson fait cela, et si nous pouvions en tirer des leçons", explique le professeur Jan Philipp Junker, responsable du laboratoire de biologie quantitative du développement à l'Institut de biologie des systèmes médicaux de Berlin (BIMSB), qui fait partie du Centre Max Delbrück de médecine moléculaire de l'Association Helmholtz (MDC) à Berlin. En collaboration avec le Dr Daniela Panáková, qui dirige le laboratoire de signalisation électrochimique dans le développement et les maladies au MDC, les chercheurs ont simulé des lésions d'infarctus du myocarde dans le cœur de leur poisson zèbre. À l'aide d'analyses unicellulaires et d'arbres de lignée cellulaire, ils ont suivi la régénération des cardiomyocytes. Ils ont maintenant publié leurs observations dans la revue Nature Genetics .
Les cœurs humains s'arrêtent avant la régénération
Les chercheurs ont commencé par tenir une aiguille froide sur le cœur d'un millimètre du poisson zèbre pendant quelques secondes sous un microscope. L'aiguille tue tous les tissus qu'elle touche. Tout comme chez les patients humains victimes d'une crise cardiaque, cela provoque une réponse inflammatoire, qui est suivie d'une cicatrisation des cellules du tissu conjonctif appelées fibroblastes. "Étonnamment, la réponse immédiate à la blessure est très similaire. Mais alors que le processus chez l'homme s'arrête à ce stade, il se poursuit chez le poisson. Ils forment de nouveaux cardiomyocytes, capables de se contracter", explique Junker.
"Nous voulions identifier les signaux provenant d'autres cellules et aider à conduire la régénération", poursuit-il. L'équipe de Junker a utilisé la génomique unicellulaire pour rechercher dans le cœur blessé des cellules qui n'existent pas dans un cœur de poisson zèbre sain. Ils ont trouvé trois nouveaux types de fibroblastes qui entrent temporairement dans un état activé. Bien qu'elles soient extérieurement identiques aux autres fibroblastes, ces cellules activées peuvent lire toute une série de gènes supplémentaires responsables de la formation de protéines, comme les facteurs du tissu conjonctif comme le collagène 12.
Les fibroblastes donnent le signal de régénération
Chez l'homme, la cicatrisation (ou fibrose) est considérée comme un obstacle à la régénération du cœur. Mais les fibroblastes semblent être importants pour le processus dès qu'ils entrent dans leur état temporairement activé. Leur importance est devenue évidente lorsque Panáková a utilisé une astuce génétique pour désactiver les fibroblastes exprimant le collagène 12 chez le poisson zèbre. Résultat :pas de régénération. Junker pense qu'il est logique que les fibroblastes soient responsables de donner les signaux de réparation :"Ils se forment juste sur le site de la blessure, après tout", dit-il.
Pour identifier la source de ces fibroblastes activés, l'équipe de Junker a produit des arbres de lignée cellulaire en utilisant une technique appelée LINNAEUS, que son laboratoire a développée en 2018. LINNAEUS travaille avec des cicatrices génétiques qui agissent collectivement comme un code-barres pour l'origine de chaque cellule. "Nous créons ce code-barres à l'aide de ciseaux génétiques CRISPR-Cas9. Si, après une blessure, deux cellules ont la même séquence de code-barres, cela signifie qu'elles sont liées", explique Junker. Les chercheurs ont identifié deux sources de fibroblastes activés temporairement :la couche externe du cœur (épicarde) et la couche interne (endocarde). Les cellules produisant du collagène 12 ont été trouvées exclusivement dans l'épicarde.
Différentes disciplines ont travaillé en étroite collaboration sur l'étude
Plusieurs chercheurs du MDC ont collaboré tout au long de l'étude, des expériences sur les poissons aux analyses génétiques, en passant par l'interprétation bioinformatique des résultats. "Pour moi, la chose la plus excitante était de voir à quel point nos disciplines se complétaient et comment nous pouvions vérifier les résultats de la bioinformatique sur un animal vivant", explique Sara Lelek, qui est l'un des principaux auteurs de l'étude et était responsable de l'animal essais. "C'était un gros projet qui nous a tous permis d'apporter notre expertise. Je pense que c'est pourquoi l'étude est si complète et si utile pour de nombreux chercheurs."
Le Dr Bastiaan Spanjaard, également auteur principal, est d'accord :"Parce que nous avions des domaines d'expertise si différents, nous avons souvent dû nous expliquer nos expériences et nos analyses. La régénération cardiaque est un processus complexe qui est influencé par de nombreux facteurs différents. Les expériences produit d'énormes quantités de données. Filtrer les signaux biologiques corrects à partir d'eux était extrêmement difficile.
On ne sait toujours pas si les cœurs endommagés chez les mammifères comme les humains et les souris manquent des signaux nécessaires ou de la capacité de lire les signaux. Si les signaux font défaut, des médicaments pourraient éventuellement être développés pour les simuler. Mais, dit Junker, trouver un moyen d'imiter l'interprétation du signal serait beaucoup plus difficile.
Les fibroblastes aident également à former de nouveaux vaisseaux sanguins
Les chercheurs veulent maintenant s'intéresser de plus près aux gènes que les fibroblastes temporairement activés lisent particulièrement souvent. Ils savent que bon nombre des gènes en question sont importants pour la libération de protéines dans la zone environnante. Et ceux-ci pourraient inclure des facteurs qui influencent également les cardiomyocytes. Et les premières preuves suggèrent que les fibroblastes activés ne favorisent pas seulement la régénération du cœur; ils contribuent également à la formation de nouveaux vaisseaux sanguins qui alimentent le cœur en oxygène.