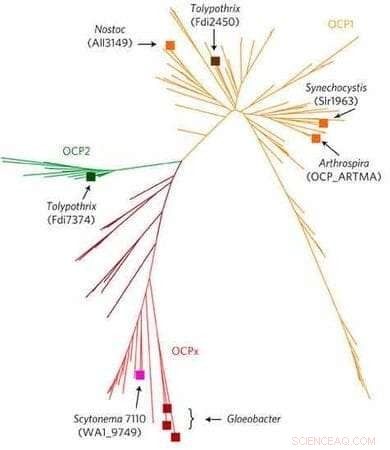
L'arbre montre l'évolution des OCP chez les cyanobactéries, en commençant par l'ancêtre Gloeobacter (en bas). OCP2 (vert) se produit plus tôt, et est donc plus primitif, que OCP1 (jaune). Frémyelle, (dans ce tableau, Tolypothrix) code des gènes pour les deux types d'OCP. Crédit :laboratoire Kerfeld. Réimprimé avec la permission de Macmillan Publishers Ltd : Plantes naturelles 3, Numéro d'article :17089, droit d'auteur (2017, Groupe d'édition de la nature).
Lorsque Han Bao a commencé à chercher une nouvelle espèce de cyanobactérie à étudier, elle n'avait aucune idée que le candidat parfait était juste en haut.
Han fait partie du projet du laboratoire Kerfeld autour de la protéine caroténoïde orange (OCP), une protéine qui réagit à la lumière de l'environnement pour protéger ses hôtes, cyanobactéries (anciennement appelées « algues bleu-vert »).
L'intérêt pour l'OCP est double :d'une part, il joue un rôle prépondérant dans la photosynthèse cyanobactérienne, et le laboratoire de Kerfeld veut comprendre comment cela fonctionne.
Ils souhaitent ensuite utiliser ces connaissances pour repenser cette protéine pour des applications dans les énergies renouvelables et la médecine.
Et après que Han et ses collègues de laboratoire aient effectué une analyse bioinformatique sur les génomes cyanobactériens (un génome est une copie complète du plan d'ADN d'un organisme), elle a découvert le labo de Montgomery, également au Laboratoire de Recherche Végétale MSU-DOE, se spécialise dans une espèce qui faciliterait son étude d'une nouvelle famille de protéines OCP qu'elle a identifiée.
Son étude, publié dans la revue Plantes naturelles (l'article a fait la couverture du journal), présente et décrit cette nouvelle famille, appelé OCP2.
Un nombre croissant de génomes de cyanobactéries
"La plupart des études précédentes sur l'OCP se concentrent sur celle trouvée dans une cyanobactérie appelée Synechocystis, " dit Han. " Cet OCP, connu sous le nom d'OCP1, est très bien étudié."
Mais au cours des cinq dernières années, des centaines de génomes de cyanobactéries sont devenus disponibles pour analyse.
Les données montrent aux scientifiques comment les OCP d'aujourd'hui, et leurs homologues de domaine, ont évolué pendant des milliards d'années dans différentes cyanobactéries, se diversifier progressivement et se spécialiser dans différentes fonctions.
Après tout, les cyanobactéries sont des organismes sophistiqués, vivant dans des environnements radicalement différents autour de la planète, des régions glaciales de l'Arctique aux sources chaudes du parc national de Yellowstone.
Les OCP se sont adaptés en conséquence pour protéger les cyanobactéries d'une exposition à la lumière nocive. Et leur diversité fonctionnelle est intéressante pour développer les énergies renouvelables ou imaginer de nouveaux outils de santé, c'est pourquoi le laboratoire de Kerfeld souhaite comprendre le fonctionnement des différentes familles d'OCP.
Présentation d'OCP2
"Nous avons fait une analyse bioinformatique pour analyser tous les génomes de cyanobactéries disponibles dans la base de données, " dit Han. "Nous avons trouvé deux nouvelles familles OCP, au-delà de l'OCP1 bien étudié. Nous avons concentré notre attention sur OCP2, trouvé dans la cyanobactérie, Frémyelle, qui est étudié par le laboratoire de Montgomery."
De façon intéressante, L'évolution d'OCP a conduit à la présence d'OCP1 et d'OCP2 dans Fremyella, créant une excellente occasion de comparer les deux familles dans un seul organisme.
« Nous avons constaté que l'OCP2 a des propriétés différentes par rapport à l'OCP1. Par exemple, OCP2 réagit beaucoup plus rapidement aux changements des conditions d'éclairage environnementales."
D'autre part, OCP2 a besoin d'une intensité lumineuse comparativement plus élevée avant d'être activé pour protéger la cyanobactérie, tandis que OCP1 peut le protéger à des intensités lumineuses plus faibles.
La structure d'OCP2 est également plus simple que celle d'OCP1. Han et le laboratoire de Kerfeld pensent que de telles caractéristiques suggèrent que l'OCP2 est une protéine plus primitive.
"Nous avons plus de preuves évolutives pour étayer cette affirmation. Nous savons que OCP1 a évolué pour interagir avec une autre protéine de Fremyella, appelée FRP (protéine de récupération de fluorescence). Les FRP accélèrent la récupération de l'OCP1 dans l'obscurité. Mais, OCP2 n'interagit pas avec FRP."
Voici ce qu'elle pense qu'il s'est passé. OCP1 a évolué pour interagir avec le FRP afin d'ajouter une couche de régulation, dans sa quête pour protéger les cyanobactéries.
Bien que cette interaction supplémentaire ralentisse OCP1, cela le rend meilleur - plus raffiné - ou " plus intelligent " dans son travail.
Une bonne analogie est la paperasserie bureaucratique :l'interaction avec FRP est comme une couche supplémentaire de paperasse, qui ralentit les activités d'une entreprise. Mais habituellement, les bureaucraties établies sont plus stables.
Mais OCP2 étant primitif ne veut pas dire qu'il est moins utile, en particulier lorsque l'on considère les applications de biologie synthétique.
« Différentes familles ont des caractéristiques particulièrement intéressantes. Une autre étude dans notre laboratoire vient de montrer comment OCP1 et OCP2 fonctionnent différemment lorsque nous les séparons et les regardons. Leurs différentes propriétés seront utiles pour concevoir différentes applications, dépend des forces de chaque famille.
Le laboratoire de Kerfeld est à la recherche de plus de familles OCP, au-delà de l'OCP2, dans sa quête continue de construire une base de connaissances structurelles et fonctionnelles sur cette protéine.