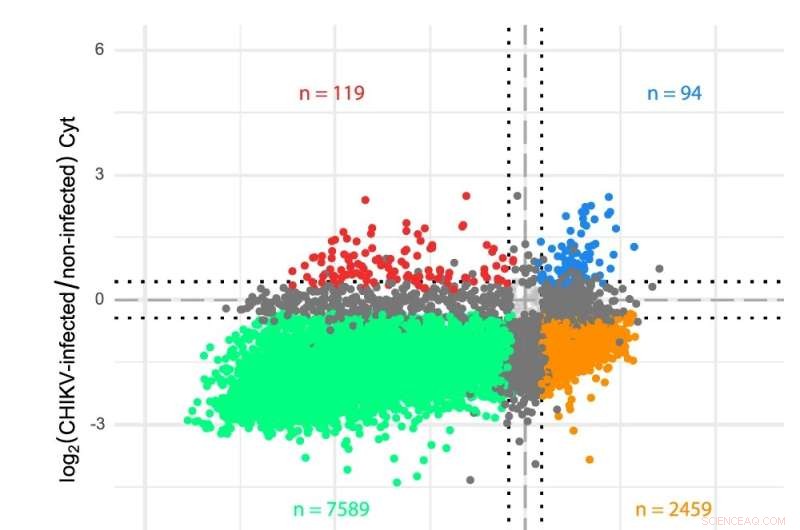
un schéma du génome de l'ARN du CHIKV. b Analyses transcriptomiques des compartiments cytosol (Cyt) et ER dans des cellules infectées par le CHIKV. Les gènes ont été tracés en fonction de leurs changements de pli log2 dans les cellules infectées par le CHIKV par rapport aux cellules non infectées pour les deux compartiments de traduction. Les lectures de séquençage ont été analysées à l'aide d'une annotation de transcriptome personnalisée et l'expression différentielle a été déterminée via limma-voom (voir Méthodes). Les couleurs indiquent les gènes significativement (FDR < 0,05) régulés à la baisse dans les deux compartiments (vert), régulés à la hausse dans les deux compartiments (bleu), régulés à la hausse ou à la baisse dans un seul compartiment (gris foncé) ou montrent un comportement opposé dans les deux compartiments (orange et rouge). Les lignes pointillées indiquent des changements de pli log2 de ± 0,433 (c'est-à-dire un changement de 35 % dans les deux sens) utilisés comme seuil minimum pour déclarer les niveaux d'ARNm comme modifiés. Les cellules HEK 293T ont été infectées à un MOI de 4 et des échantillons ont été prélevés douze heures après l'infection. Trois répétitions indépendantes ont été effectuées pour chaque condition. Crédit :Nature Communications DOI :10.1038/s41467-022-31835-x
Le groupe de recherche en virologie moléculaire de l'Université Pompeu Fabra (UPF), en collaboration avec le groupe Epitranscriptomics and RNA Dynamics du Center for Genomic Regulation (CRG), a découvert un nouveau mécanisme par lequel les virus modifient la machinerie cellulaire pour mieux lire les instructions dans le génome du virus envahisseur et produisent ainsi de grandes quantités de descendance virale. L'étude a été publiée dans Nature Communications et était dirigé par Juana Díez.
Les gènes contiennent les informations nécessaires à la formation des protéines, molécules complexes essentielles à la vie, formées à partir d'acides aminés. La lecture de ces informations se déroule en deux étapes principales, la première étant la transcription, au cours de laquelle l'information du gène (ADN) est transférée à une molécule appelée ARN messager (ARNm). L'ARNm est constitué d'un "texte" formé de triplets de nucléotides (les lettres GCT, CAT, etc.). Chaque triplet correspond à un acide aminé. La deuxième phase est la traduction, dans laquelle une molécule appelée ARN de transfert (ARNt) reconnaît chaque triplet et agit comme un traducteur en apportant l'acide aminé correspondant. Les protéines sont construites via ce processus.
Il y a 61 codons et 20 acides aminés, et autant de triplets codent pour le même acide aminé. Chaque organisme utilise de préférence l'un de ces triplets (triplet optimal) car il a une concentration plus élevée de l'ARNt qui reconnaît ce triplet. Ainsi, lorsque le "texte" de l'ARNm est enrichi en triplets optimaux, les protéines seront générées rapidement et efficacement alors que lorsqu'elles sont enrichies en triplets non optimaux, l'efficacité de l'expression diminuera car les ARNt apparentés sont rares.
Les virus sont très simples et pour se multiplier et exprimer leurs protéines, ils ont besoin de détourner la machinerie cellulaire de l'hôte. Les virus génèrent leur propre ARNm dans les cellules qu'ils infectent, que ces dernières lisent et génèrent des protéines virales pour produire plus de virus. Mais les ARNm de nombreux virus, dont le SRAS-CoV-2 et les virus transmis par les moustiques dengue, zika et chikungunya, sont enrichis en triplets non optimaux et expriment encore des protéines virales avec une grande efficacité. "Pour résoudre ce dilemme, nous avons utilisé le virus du chikungunya comme modèle car son génome se multiplie à des niveaux extrêmement élevés", expliquent Jennifer Jungfleisch et René Böetcher, co-auteurs de l'étude.
"Nos résultats montrent pour la première fois que les virus modifient l'ARNt de l'hôte pour adapter la machinerie de traduction de l'hôte au texte de l'ARNm viral", explique Marc Talló, également co-auteur de l'article. "En d'autres termes, l'infection virale induit un changement de langage dans la cellule, de sorte qu'elle exprime très efficacement les protéines virales. Comme les protéines virales sont essentielles à la production de virus, ce changement sera finalement responsable de la génération d'un grand nombre de virus. dans la cellule infectée », ajoute-t-il.
"Bien que l'étude se soit concentrée sur le virus du chikungunya, notre proposition est que la modification des ARNt induite par une infection virale est un mécanisme général suivi par de nombreux virus", explique Juana Díez, professeur titulaire au Département de médecine et des sciences de la vie de l'UPF.
"De plus, nos résultats fournissent une base pour considérer la régulation de l'ARNt comme une nouvelle cible thérapeutique prometteuse pour le développement d'antiviraux à large spectre efficaces contre plusieurs virus", conclut Díez. L'étude a également impliqué le groupe de recherche coordonné par Eva María Novoa au CRG, et les autres auteurs sont Gemma Pérez-Vilaró et Andres Merits (Institut de technologie, Université de Tartu). Les virus s'adaptent au "langage des cellules humaines" pour détourner la synthèse des protéines