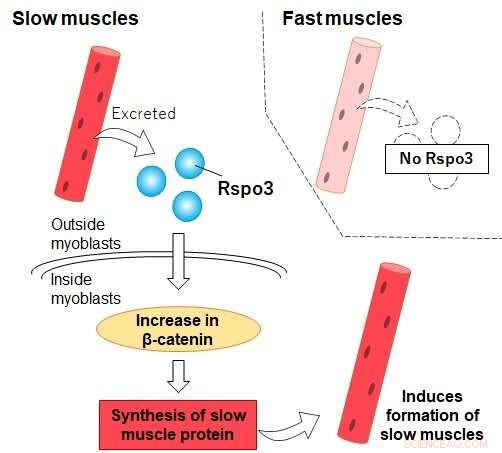
Rspo3 est excrété par les fibres « lentes » de type I (et non par les fibres « rapides »), ce qui favorise l'accumulation de bêta-caténine à l'intérieur des myoblastes. Cela conduit à une production accrue de MyHC I et à la différenciation éventuelle du myoblaste en une fibre de type I. Crédit :Université métropolitaine de Tokyo
Des chercheurs de l'Université métropolitaine de Tokyo ont découvert qu'une protéine excrétée par les fibres musculaires de type I (lentes), essentielles à l'endurance musculaire, peut entraîner la différenciation des myoblastes environnants en fibres de type I. Cela bouleverse la sagesse dominante qui dit que notre rapport fibre rapide / lente ne peut pas être modifié de manière significative. Ils ont également identifié la voie chimique par laquelle la protéine affecte la différenciation. De telles découvertes pourraient un jour conduire à des thérapies pour contrôler la santé des muscles lents.
Le tissu musculaire squelettique est composé de centaines de milliers de fibres qui se contractent sur commande. Cependant, ils ne sont pas tous pareils. Il existe des fibres musculaires « lentes » de type I, importantes pour les exercices d'endurance, et des fibres « rapides » de type II, qui peuvent réagir beaucoup plus rapidement mais sur des périodes plus courtes. Les fibres de type I pourraient être assimilées aux coureurs de marathon, tandis que les fibres de type II pourraient être appelées sprinters. Pendant longtemps, la sagesse dominante a été que le rapport entre les fibres de type I et de type II dans nos muscles est en grande partie déterminé à la naissance.
Mais les scientifiques commencent à découvrir que ce n'est pas le cas. Une équipe de chercheurs de l'Université métropolitaine de Tokyo dirigée par le professeur Nobuharu Fujii vient de découvrir qu'une protéine sécrétée par le muscle de type I connue sous le nom de R-spondin3 (Rspo3) pourrait détenir la clé du développement de nouvelles fibres de type I. Lorsque les myoblastes, précurseurs des cellules musculaires, ont été traités avec Rspo3, ils ont commencé à produire des quantités significativement plus élevées de Myosin Heavy Chain I (MyHC I), une protéine produite par le muscle de type I.
L'effet semblait être unique aux myoblastes aux premiers stades de leur développement. Cela signifie que les fibres de type I induisent activement la formation de plus de fibres de type I dans leur voisinage, excrétant Rspo3 et agissant sur la différenciation des cellules voisines. La découverte jette un nouvel éclairage sur le rôle des muscles dans notre corps et renverse la sagesse conventionnelle qui dit que le rapport des fibres de type I à type II ne peut pas être modifié. L'équipe a également pu montrer que cela se produisait via une cascade spécifique de réactions chimiques appelée voie Wnt/bêta-caténine, responsable de l'accumulation nécessaire de bêta-caténine à l'intérieur des cellules. Des expériences visant à réduire artificiellement la quantité de bêta-caténine dans les cellules, par exemple, ont conduit à la suppression de l'expression accrue de MyHC I.
Le diabète de type 2 et le manque d'exercice sont deux des nombreuses raisons pour lesquelles les fibres musculaires lentes peuvent s'atrophier. Les découvertes de l'équipe suggèrent qu'il est effectivement possible d'encourager spécifiquement le développement des fibres de type I par des moyens thérapeutiques. Par exemple, Rspo3 peut être utilisé directement comme traitement, ou utilisé pour différencier les cellules musculaires prélevées sur un patient avant que le tissu ne soit replanté. Si les cellules peuvent excréter Rspo3 et affecter les cellules environnantes, les avantages ne se limiteront pas à la masse réintroduite. De telles connaissances promettent de nouvelles possibilités intéressantes pour les traitements visant à améliorer la fonction musculaire, un défi majeur pour les populations et la société vieillissantes.
L'étude apparaît dans Rapports scientifiques . Les muscles semblent grossir, plutôt que rétrécir, chez certains patients COVID gravement malades