Il existe de nombreuses façons pour les microbes résistants aux antibiotiques de pénétrer dans le corps humain. Crédit :Biorender, fourni par l'auteur
Des maux de gorge aux fièvres et aux infections potentiellement mortelles, la plupart des gens ont utilisé périodiquement des antibiotiques. Des rapports récents montrent que la pandémie mondiale de COVID-19 a augmenté l'utilisation d'antibiotiques.
Certains microbes peuvent être naturellement résistants à certains antimicrobiens. Dans d'autres cas, une mauvaise utilisation des antimicrobiens favorise la modification des gènes microbiens (les gènes sont des unités d'ADN), rendant les microbes résistants aux antimicrobiens. L'homme à l'origine de la découverte des antibiotiques, Alexander Fleming, a donné un avertissement anticipé sur ce sujet dans sa conférence Nobel de 1945 :
"Monsieur X. a mal à la gorge. Il achète de la pénicilline et s'en donne, pas assez pour tuer les streptocoques (bactéries connues pour provoquer des maux de gorge et des amygdales) mais assez pour les éduquer à résister à la pénicilline. Il infecte alors sa femme. . X attrape une pneumonie et est traité avec de la pénicilline. Comme les streptocoques sont maintenant résistants à la pénicilline, le traitement échoue. Mme X décède. Qui est principalement responsable de la mort de Mme X ?"
Cette situation est appelée résistance aux antimicrobiens et les gènes qui confèrent la résistance sont appelés gènes de résistance aux antimicrobiens (ARG).
Gènes de résistance aux antimicrobiens
À l'échelle mondiale, les problèmes de santé dus à la résistance aux antimicrobiens ont augmenté. L'une des principales raisons est la mobilité des ARG. Les gènes de résistance peuvent être transférés d'une génération de microbes à la suivante par reproduction, et peuvent également être transférés par transfert horizontal de gènes (transfert non sexuel de matériel génétique entre différents microbes).
Cela implique que, quelle que soit leur origine, les gènes de résistance aux antimicrobiens peuvent être transmis de sources environnementales à l'intestin humain, et vice-versa.
En tant qu'ingénieurs en environnement, nos recherches à l'Université McGill se concentrent sur le développement d'outils pour surveiller le mouvement des gènes de résistance aux antimicrobiens dans les eaux usées et sur la compréhension de l'impact du transfert d'ARG sur les microbes intestinaux humains. Outre la transmission interhumaine des microbes résistants décrite par Fleming, ces microbes peuvent pénétrer dans le corps humain de plusieurs autres façons.
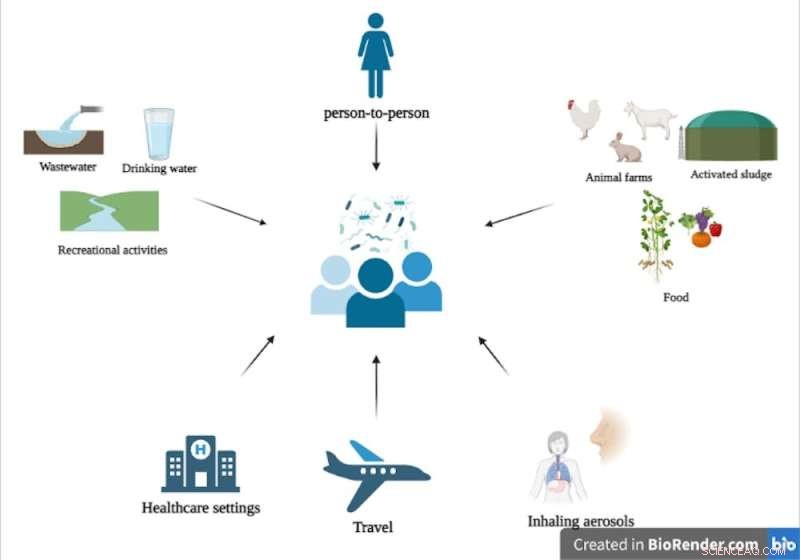
Différentes voies de transfert des gènes de résistance aux antimicrobiens de l'environnement vers l'intestin humain. Crédit :BioRender.com, fourni par l'auteur
Eaux usées
Les eaux usées sont un puits pour les activités humaines et contiennent des gènes de résistance provenant des excréments humains, des fermes, des ménages et des hôpitaux. Les eaux usées traitées sont souvent rejetées dans les eaux de surface telles que les rivières, qui sont utilisées pour des activités récréatives telles que les sports, la pêche et la natation. Une étude transversale a révélé que l'intestin des surfeurs est trois à quatre fois plus susceptible d'être colonisé par des microbes multirésistants que l'intestin des non-surfeurs.
De plus, l'eau potable est obtenue à partir d'eaux de surface ou souterraines traitées. La recherche a montré que les biofilms de l'eau potable (agrégation de microbes vivant sur les surfaces) peuvent transférer des gènes de résistance aux antimicrobiens dans l'intestin de la souris, indiquant qu'ils pourraient également être transférés dans l'intestin humain.
Nourriture
Pour augmenter la productivité animale, les antimicrobiens sont souvent appliqués dans les fermes, ce qui peut conduire à la sélection et au développement de gènes de résistance. L'épandage de fumier animal et de boues (sous-produit du traitement des eaux usées) dans l'agriculture peut favoriser le transfert de gènes de résistance aux antimicrobiens aux cultures vivrières. Il a été constaté que plusieurs ARG se déplacent du sol vers les parties comestibles des plantes telles que les tomates, la laitue et les fèves.
Aérien
Les gènes de résistance aux antimicrobiens inhalables constituent une menace silencieuse croissante pour la santé. Des rapports récents d'échantillons hospitaliers ont révélé que l'exposition humaine quotidienne aux bactéries résistantes contenues dans les aérosols est 10 fois supérieure à celles présentes dans l'eau potable.
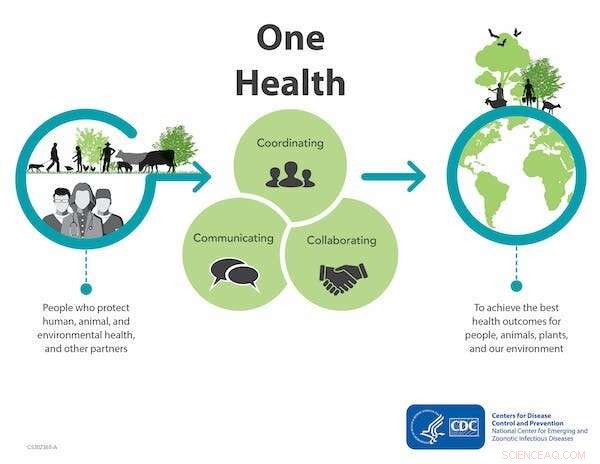
Approche One Health pour lutter contre la résistance aux antimicrobiens. Crédit :Centres de contrôle et de prévention des maladies
Établissements de santé
Les établissements de soins de santé sont l'un des endroits les plus importants pour acquérir des infections multirésistantes en raison de la présence d'agents pathogènes opportunistes qui infectent les patients immunologiquement compromis. La présence d'antimicrobiens aide davantage au développement et à la sélection de microbes résistants, qui peuvent ensuite être transférés d'un patient à d'autres par contact interpersonnel ou via des surfaces communes telles que des poignées de porte, des barrières de lit ou des casiers.
Voyage
Les voyageurs internationaux qui se sont rendus dans les pays en développement ont contracté des bactéries multirésistantes. Ils peuvent avoir acquis ces microbes via des aliments et de l'eau contaminés, en raison de mauvaises pratiques d'hygiène ou en raison de politiques d'utilisation différentielles des antimicrobiens d'un pays à l'autre.
Une approche One Health
Il est évident que des microbes résistants aux antimicrobiens nous entourent et il est normal de se sentir concerné. Mais ce qui est encore plus important à reconnaître, ce sont les petites étapes que nous pouvons tous encore adopter. Cela inclut de s'assurer que les patients sont traités avec l'antibiotique approprié à la bonne dose.
On a global level, understanding the transmission routes for resistant microbes is a part of a One Health approach. The holistic concept of One Health acknowledges that the health of humans is interconnected to the health of animals and our surrounding environment. This enables bringing together resources and policies to monitor and tackle antimicrobial resistance.
Indeed, resistant microbes are running a marathon with antimicrobials, and we need to take measures to slow down their pace. In the long run, this would ensure that the antimicrobials would continue to support human survival.
Cet article est republié de The Conversation sous une licence Creative Commons. Lire l'article d'origine. Modeling antimicrobial use and resistance in Canadian turkey flocks
