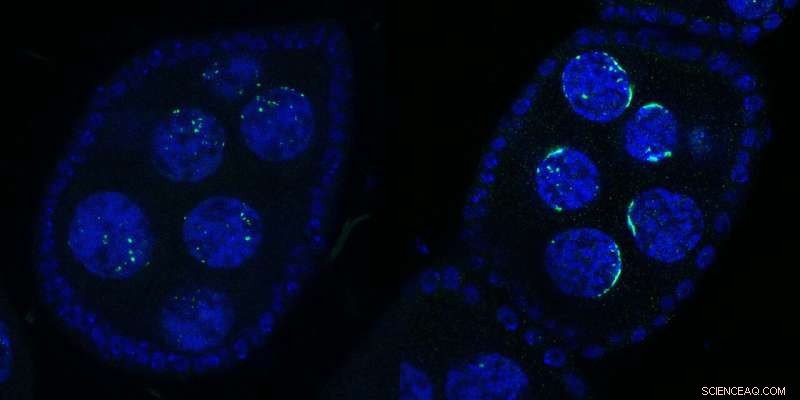
Deux chambres d'œufs de Drosophile contenant plusieurs noyaux :Wild Type (à gauche) ou lors de l'inactivation de Kipferl (à droite). L'ADN est représenté en bleu et Rhino en vert. Lors de la mutation ou de la suppression de la protéine partenaire Kipferl (à droite), Rhino perd son affinité pour les séquences de grappes de piRNA à travers le génome (points verts dans le panneau de gauche) mais est séquestré par les réseaux satellites péricentromériques (formes vertes en forme de croissant dans le droit panneau). Les formes en croissant ont inspiré le nom "Kipferl", le nom d'une pâtisserie autrichienne. Crédit :Baumgartner/Brennecke/IMBA
Une grande partie de notre ADN est constituée d'éléments d'ADN répétitifs égoïstes, dont certains peuvent sauter d'un site du génome à un autre, endommageant potentiellement le génome. Des chercheurs de l'Institut de biotechnologie moléculaire de l'Académie autrichienne des sciences (IMBA) décrivent comment différents types d'éléments d'ADN répétitifs sont contrôlés par le même mécanisme de silence dans les ovaires de la mouche des fruits.
Au centre de leurs découvertes se trouve une protéine non caractérisée que les chercheurs ont nommée "Kipferl", qui assure le contrôle efficace des gènes sauteurs. Les résultats suggèrent que différents éléments égoïstes se disputent le système de défense du génome de l'hôte et que Kipferl pourrait être la première d'une série de molécules agissant de manière similaire à découvrir. Les résultats sont publiés dans eLife .
Environ la moitié du génome humain et un cinquième du génome de la drosophile sont composés de parasites génétiques ressemblant à des gènes qui peuvent se copier et s'insérer dans des zones aléatoires de notre génome, perturbant potentiellement l'expression normale des gènes. De multiples mécanismes de défense ont évolué pour contrôler ces soi-disant transposons.
L'un de ces mécanismes est un système d'interférence ARN appelé la voie piRNA. La voie piRNA est une petite voie de silençage de l'ARN conservée dans tout le règne animal, des éponges aux mammifères. Ce mécanisme de silençage utilise des piARN générés à partir de séquences riches en transposons dans l'ADN appelées « clusters de piARN ».
Les piARN sont de petits ARN qui se couplent aux protéines dites Argonaute de la machinerie de silençage pour cibler les transposons complémentaires à leur séquence. Par conséquent, ces piARN servent de modèles pour identifier et faire taire les transposons avec des séquences complémentaires dans le génome, quelle que soit la distance à laquelle ils ont pu sauter.
La mouche des fruits Drosophila melanogaster, dans laquelle la voie des piARN a été identifiée pour la première fois, utilise une protéine appelée "Rhino" pour trouver des grappes de piARN dans le génome. Cependant, la façon dont Rhino reconnaît les grappes de piARN dans l'ADN restait inconnue.
"Des données in vitro antérieures avaient montré une affinité de Rhino pour une marque épigénétique spécifique, la modification de la chromatine H3K9me3", explique Julius Brennecke, responsable du groupe IMBA, auteur correspondant de l'étude. Cette modification est un marqueur de «l'hétérochromatine», une forme d'ADN étroitement tassé dans lequel les gènes sont réduits au silence.
Cependant, H3K9me3 n'est pas spécifique aux clusters de piRNA mais est également fréquemment trouvé dans d'autres régions densément peuplées du génome. Là, H3K9me3 est lié par la principale protéine d'hétérochromatine 1 (HP1), un proche parent de Rhino.
Pourquoi HP1 et Rhino se lient à différents sous-ensembles d'hétérochromatine, même s'ils ont tous deux une affinité comparable pour la même modification de la chromatine, n'a pas été clair depuis longtemps. "Sans aucun doute, H3K9me3 était nécessaire, mais pas suffisant pour expliquer la liaison de Rhino à la chromatine. Par conséquent, nous savions qu'il devait y avoir des signaux moléculaires supplémentaires qui aident à cibler Rhino sur les grappes de piRNA", ajoute Brennecke.
Dans la recherche de ce signal moléculaire, l'équipe a catalogué les interacteurs directs de Rhino, à la recherche d'une protéine partenaire qui pourrait guider Rhino vers les grappes d'ARNpi. En utilisant une combinaison d'approches génétiques, génomiques et d'imagerie, les chercheurs ont identifié le "compagnon" de Rhino dans les ovaires de la drosophile :une protéine contenant plusieurs plis à doigts de zinc qu'ils ont appelé "Kipferl".
Kipferl ne se lie pas seulement à Rhino, mais utilise également ses doigts de zinc pour la liaison spécifique à la séquence aux motifs d'ADN riches en guanosine. L'équipe a découvert que la plupart des grappes de piARN sont définies par la combinaison des sites de liaison à l'ADN spécifiques de Kipferl avec l'hétérochromatine locale. Sur ces sites, l'interaction de Rhino avec les marques épigénétiques H3K9me3 est stabilisée par Kipferl, ce qui explique pourquoi Rhino ne se lie qu'à une petite partie de toute l'hétérochromatine présente dans le génome.
Pour ajouter un niveau de complexité, l'équipe savait que Rhino ne se localisait pas seulement sur les grappes de piARN. Récemment, il a été démontré que Rhino se lie à ce qu'on appelle des "matrices de satellites". Ce sont des séquences répétitives d'ADN non codant et non transposant situées à proximité des centromères des chromosomes.
"Nous avons constaté un effet saisissant sur Rhino lorsque nous avons généré des mouches avec Kipferl mutant ou absent et que nous les avons examinées au microscope", explique la première auteure Lisa Baumgartner, doctorante au laboratoire Brennecke de l'IMBA. Lorsque Kipferl a été muté, Rhino n'est plus localisé dans les grappes de piRNA à travers le génome. Au lieu de cela, il s'est fortement accumulé dans les réseaux satellites génomiques.
"Au lieu de points plus petits répartis autour du noyau, nous avons vu Rhino former des formes distinctes en forme de croissant. Sur la base de cette toute première observation, nous avons nommé la nouvelle protéine 'Kipferl', d'après une pâtisserie autrichienne populaire en forme de croissant. Nous n'avons découvert que beaucoup plus tard que ces structures correspondaient à des tronçons de méga-base de réseaux satellites." Par conséquent, les scientifiques ont montré que Kipferl aidait à distribuer correctement Rhino aux grappes de piARN et à éviter sa séquestration dans les baies satellites.
Rhino est l'une des protéines évoluant le plus rapidement dans le génome de la mouche. Brennecke et son équipe émettent l'hypothèse que cette évolution rapide pourrait bien être due à une pression évolutive positive provenant des réseaux satellites.
"Les puces Satellite ne se transposent pas mais peuvent se recombiner. Cependant, si elles le font de manière incontrôlée, des bras chromosomiques entiers pourraient être perdus. Par conséquent, les puces Satellite pourraient avoir besoin d'un mécanisme de contrôle impliquant Rhino et d'autres composants de la voie piARN pour les conditionner en hétérochromatine serrée. C'est peut-être la raison pour laquelle les réseaux Satellite semblent vouloir séquestrer tout le Rhino qu'ils pourraient trouver », explique Baumgartner.
Baumgartner pense que Rhino et la voie des piARN pourraient avoir des rôles très différents dans leurs interactions avec les réseaux satellites ou les grappes et les transposons de piARN. "Le saut et la multiplication des transposons présentent un danger pour la fonctionnalité du génome, ce qui rend nécessaire que la voie piRNA les fasse taire", dit-elle.
"Par conséquent, aux yeux des transposons, la voie des piARN est "l'ennemi" qui les empêche de se propager à travers le génome. Les réseaux satellites, en revanche, ont simplement besoin d'une couche de contrôle supplémentaire pour s'assurer qu'ils peuvent conserver leur copie élevée. nombre sans endommager le génome par une recombinaison indésirable. Par conséquent, aux yeux des baies Satellite, j'imagine que Rhino est un facteur qui assure leur survie », explique-t-elle.
Sur la base de ces observations et analyses, les scientifiques suggèrent que les réseaux Satellite pourraient utiliser une autre protéine partenaire comme Kipferl pour aider à localiser Rhino dans leur ADN.
"Pour contrer la séquestration de Rhino par les réseaux satellites, nous supposons que Kipferl pourrait avoir évolué par nécessité pour aider à recibler Rhino vers les grappes de piARN. Par conséquent, nos découvertes suggèrent que Rhino pourrait être pris entre deux feux de conflits génétiques", dit Brennecke. De plus, Rhino est exprimé à la fois dans les testicules et les ovaires de la mouche des fruits, tandis que Kipferl n'est exprimé que dans les ovaires. "Kipferl pourrait être le premier de plusieurs facteurs de guidage de Rhino encore à découvrir", conclut Brennecke. Comment les cellules piratent leurs propres gènes