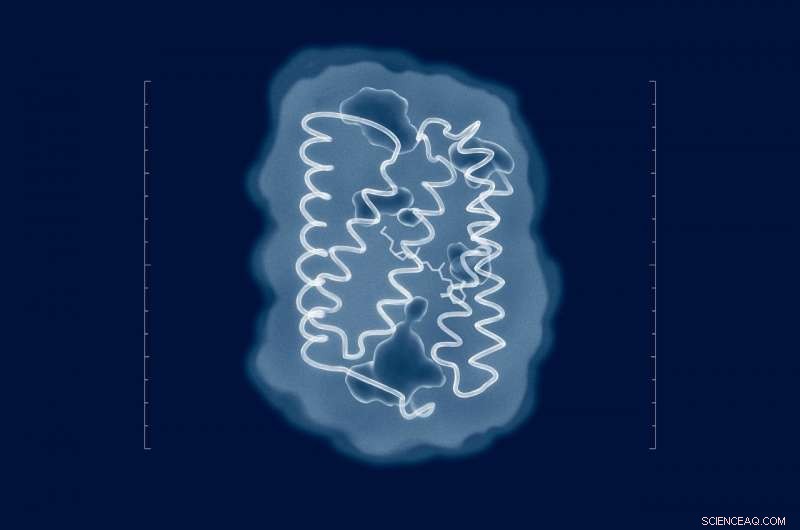
Les tentatives pour résoudre la structure de ChR2 remontent à l'époque de sa découverte en 2003. Mais malgré les efforts de nombreux groupes de recherche du monde entier, la structure de la protéine dans son état naturel est restée inconnue. Maintenant que les chercheurs ont la structure, des mutations significatives peuvent être introduites dans la protéine pour ajuster ses propriétés aux exigences d'une expérience spécifique. Crédit :MIPT
Une équipe internationale de chercheurs a déterminé la structure 3-D de la channelrhodopsine 2, une protéine membranaire largement utilisée en optogénétique pour contrôler les cellules nerveuses avec la lumière. L'optogénétique est une technique relativement nouvelle qui implique l'utilisation de la lumière pour manipuler les cellules nerveuses et musculaires d'un organisme vivant. Des approches similaires sont utilisées pour inverser partiellement la perte de l'audition et de la vue et contrôler les contractions musculaires.
En outre, les méthodes d'optogénétique sont utilisées pour étudier les propriétés des réseaux de neurones naturels, qui sont responsables de l'émotion, la prise de décision, et d'autres processus complexes dans les organismes vivants. L'optogénétique était La nature 's "Méthode de l'année 2010, " ainsi que d'être nommé parmi Science 's "Percées de 2010 et aperçus de la décennie."
Canalrhodopsine 2, ou ChR2, est un outil optogénétique majeur. C'est une protéine sensible à la lumière qui a été extraite à l'origine en 2003 d'une algue verte appelée Chlamydomonas reinhardtii. Les scientifiques peuvent insérer ChR2 dans la membrane d'une cellule vivante pour la contrôler. Lorsqu'il est allumé, cette protéine permet aux ions chargés positivement de passer dans la cellule à travers la membrane cellulaire. Dans une cellule nerveuse, cela dépolarise la membrane, imitant l'effet d'une impulsion nerveuse et provoquant le déclenchement de ce neurone particulier.
Parce que ChR2 agit rapidement et est relativement inoffensif pour les cellules, c'est la solution de référence actuelle pour l'activation des cellules nerveuses. Une gamme de mutations induites artificiellement sont disponibles pour modifier les propriétés de la protéine. Par exemple, il est possible d'augmenter le courant qu'il génère ou de modifier la longueur d'onde de la lumière à laquelle il répond. De telles modifications permettent aux expérimentateurs de travailler avec des protéines adaptées à leurs besoins. Les chercheurs peuvent même combiner plusieurs variantes de protéines pour une réponse distincte à différentes longueurs d'onde de la lumière.
La plupart des mutations utilisées pour modifier les propriétés de ChR2 ont jusqu'à présent été introduites plus ou moins au hasard, soit via une évolution dirigée, soit sur la base des données sur les structures protéiques connues. Les chercheurs les plus proches qui sont jamais parvenus à une structure ChR2 réaliste est une combinaison étrange appelée C1C2, dont 70 % à base de ChR1, une protéine apparentée, avec le reste basé sur le ChR2 réel. Cette structure mixte ne peut pas rendre compte de toutes les propriétés de la protéine. Par conséquent, les mutations prédites par ce modèle ne sont pas tout à fait réalistes et sont donc d'un intérêt limité pour l'optogénétique.
Pour révéler la structure de ChR2, les auteurs de l'étude ont utilisé une technique analytique appelée diffraction des rayons X, qui ne fonctionne qu'avec des échantillons sous forme de cristal. Ceux-ci ont été obtenus par les chercheurs via une cristallisation in méso. C'est-à-dire, les cristaux de protéines ont été cultivés dans ce qu'on appelle la mésophase lipidique cubique, un milieu qui permet aux protéines de se déplacer librement sans quitter la membrane. Pour déterminer les structures des protéines, leurs cristaux ont été irradiés avec des rayons X à une longueur d'onde d'environ 1 angström, qui est légèrement inférieure à la longueur des liaisons entre les atomes de la protéine. En cristallographie aux rayons X, Les structures sont dérivées en analysant la façon dont le rayonnement est diffusé par un échantillon.
"Les tentatives pour résoudre la structure de ChR2 remontent à l'époque de sa découverte en 2003. Mais malgré les efforts de nombreux groupes de recherche du monde entier, la structure de la protéine à l'état naturel est restée inconnue, " dit Valentin Borchtchevskiy, l'un des auteurs de l'article et directeur adjoint du Laboratoire d'études avancées des protéines membranaires au MIPT. "Maintenant que nous avons la structure, des mutations significatives peuvent être introduites dans la protéine pour ajuster ses propriétés aux exigences d'une expérience spécifique. Ne connaissant pas la structure, nous avons dû laborieusement déterminer les mutations utiles par essais et erreurs ou nous contenter des données sur les protéines apparentées. »