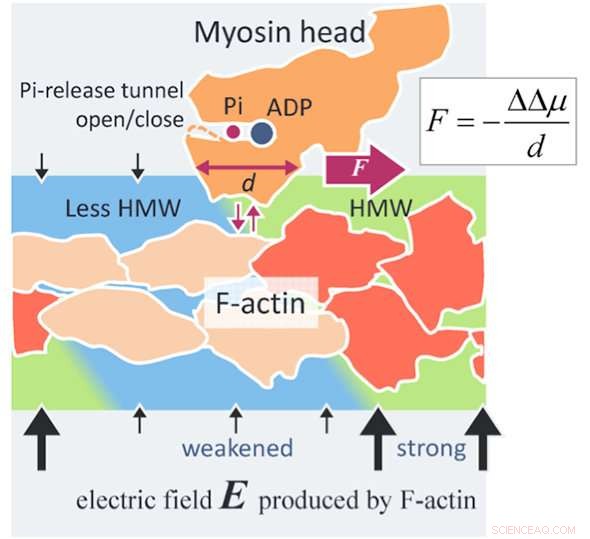
Un nouveau mécanisme de génération de force de l'actomyosine. Un filament d'actine (F-actine) produit un champ électrique (flèches noires) pouvant atteindre 100 MV/m autour de la F-actine en raison de ses charges de surface négatives. Les molécules d'eau dans un champ électrique aussi élevé deviennent des molécules d'eau hypermobiles (HMW, vert clair) à proximité immédiate de la F-actine. D'autre part, L'ATP en solution se lie à une tête de myosine (orange) et est divisé en adénosine diphosphate (ADP) et en phosphate inorganique (Pi) dans la tête. Lorsque la tête de myosine avec ADP et Pi se lie à la F-actine (rouge orange), plusieurs sous-unités d'actine changent de structure (beige). Ensuite, l'intensité du champ électrique diminue autour de ces sous-unités d'actine modifiées et l'intensité HMW diminue également (bleu clair) pour se rapprocher de l'eau libre. Dans la présente étude, l'état d'hydratation des protéines s'est avéré plus stable dans la région HMW plus forte. Dans la figure, la tête de myosine est dirigée vers la droite où l'intensité HMW est plus forte (vert clair), en se détachant de la F-actine et en se fixant à nouveau avec la F-actine. La force évaluée par la présente méthode est aussi élevée que plusieurs piconewtons, ce qui est au niveau des valeurs expérimentales. Cela peut être un principe de nouvelle force de surface agissant entre une macromolécule chargée, comme les protéines et l'ADN, et une protéine de soluté largement applicable à la science et à la technologie. Crédit :Makoto Suzuki
Le complexe d'actine et de myosine (actomyosine) génère la force de contraction d'un muscle en utilisant la réaction d'hydrolyse de l'adénosine triphosphate (ATP). De nombreuses tentatives ont ainsi été faites pour expliquer l'origine moléculaire de la motilité de l'actomyosine.
Un modèle de course de puissance de la myosine, proposé par Huxley et Simmons en 1971, a initié de nombreuses recherches, y compris des études de structure atomique et l'étude de la biologie moléculaire des molécules de myosine et d'actine. Le modèle de course de puissance, modifié dernièrement, est largement adopté dans les manuels de biologie standard.
Cependant, il reste un sérieux problème. D'après les données de thermodynamique expérimentale, l'hydrolyse de l'ATP dans la tête de myosine ne produit pas un état de myosine avec une énergie suffisamment élevée pour générer la force de contraction.
Maintenant, un groupe de recherche, dirigé par le professeur émérite Makoto Suzuki à l'université de Tohoku en collaboration avec le professeur Nobuyuki Matubayasi à l'université d'Osaka, a réussi à expliquer le mécanisme d'entraînement de l'actomyosine selon les données de thermodynamique expérimentale.
Dans l'étude, la structure de l'eau à proximité immédiate d'un filament d'actine (F-actine) est modifiée lors de la liaison avec une tête de myosine hydrolysant l'ATP en F-actine, cela conduit à une modification de l'affinité avec la tête de myosine et donc à la génération de la force motrice de l'actomyosine.
La présence de la nouvelle force de surface intermoléculaire - qui a été démontrée pour la première fois sur la base des analyses d'hydratation actuelles - a été une découverte marquante. Cet article est, donc, le premier à dévoiler avec succès le mécanisme d'entraînement de l'actomyosine en introduisant une nouvelle force de surface intermoléculaire.