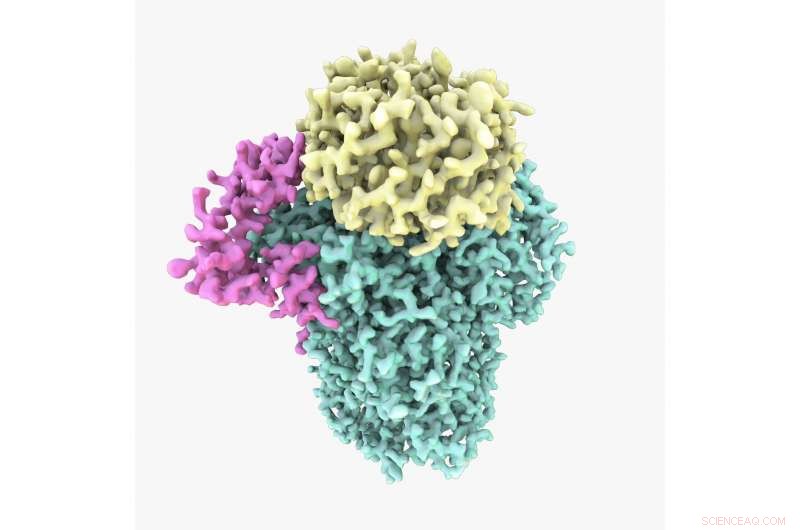
Structure cryo-EM de la protéine CPF. L'étude a montré que le CPF est assemblé à partir de trois sous-unités :Cft1 en vert, Yth1 en magenta et Pfs2 en jaune. Crédit :A. Casañal &T. Martin à la MRC LMB
La technique de cryomicroscopie électronique - pour laquelle le scientifique du MRC, le Dr Richard Henderson a remporté un prix Nobel plus tôt ce mois-ci - a maintenant été utilisée pour résoudre la structure d'un complexe protéique essentiel à l'expression des gènes.
Dans le journal, publié dans Scienceouvre dans une nouvelle fenêtre, les chercheurs disent que la structure indique comment le virus de la grippe humaine est capable de perturber la machinerie d'expression des gènes des cellules.
L'étude, dirigé par le Dr Lori Passmoreouverture dans une nouvelle fenêtre du Laboratoire de biologie moléculaire du MRC, est le premier à révéler la structure d'une partie importante de la protéine, appelé facteur de clivage et de polyadénylation (CPF).
Le CPF est une enzyme complexe composée de plusieurs sous-unités. La microscopie cryoélectronique a révolutionné la capacité des scientifiques à découvrir la structure de grandes, protéines flexibles et complexes comme celle-ci sous leur forme naturelle.
Dr Lori Passmore, auteur principal de l'article et chef de groupe à la MRC LMB, a déclaré : « Comprendre la structure et la fonction d'un CPF intact, et comment il est assemblé, est une question centrale dans le domaine de l'expression génique depuis des décennies – c'est une protéine tellement fondamentale mais nous ne comprenons toujours pas comment elle fonctionne. C'était un énorme défi technique car très peu de structures ont été entièrement construites à partir de zéro en utilisant des données cryo-EM. Nous étions très enthousiastes à l'idée de finalement construire le premier modèle atomique de la structure d'une partie de CPF."
Le CPF donne sa queue à l'expression des gènes
L'expression des gènes - transformer les instructions codées dans l'ADN en protéines - nécessite un certain nombre d'étapes importantes. Les enzymes copient le gène et produisent une version simple brin de l'ADN, appelé ARN messager (ARNm).
L'ARNm peut sortir du noyau de la cellule, où se trouve l'ADN, vers le cytoplasme où la machinerie cellulaire utilise les instructions de l'ARNm pour assembler une protéine.
L'enzyme CPF est une partie nécessaire de ce processus - elle ajoute une longue chaîne de molécules d'adénosine, appelé "queue poly-A", à la fin de chaque nouvel ARNm.
Cette queue est importante car la longueur de la queue spécifie la durée pendant laquelle l'ARNm est présent dans la cellule, et à quelle fréquence il est traduit en protéines. La queue poly-A est également nécessaire pour que l'ARNm soit transporté hors du noyau.

Crédit :Conseil de recherches médicales
Ciblé par la grippe
Infections virales, comme la grippe, cibler le CPF dans la cellule et perturber l'expression des gènes. Les chercheurs ont identifié un site sur le CPF où une protéine du virus peut se lier de manière à empêcher le CPF d'interagir avec l'ARNm, et stopper ainsi l'expression des gènes dans la cellule à l'avantage du virus.
Les scientifiques disent que cette structure les aidera également à mieux comprendre comment fonctionne le CPF et comment les défauts de l'addition de la queue poly-A contribuent aux maladies - y compris la -thalassémie, thrombophilie, et cancéreux.
Le Dr Passmore a déclaré :« C'est un projet à long terme dans mon laboratoire et de nombreuses personnes y ont contribué au cours des sept dernières années. Je me souviens encore avoir vu les premières images de CPF en 2010. Maintenant, avoir la structure de CPF permettra de futures recherches sur le fonctionnement de cette protéine importante dans les cellules normales, mais cela ouvre également des opportunités pour comprendre son rôle dans les infections virales et les maladies telles que le cancer. »