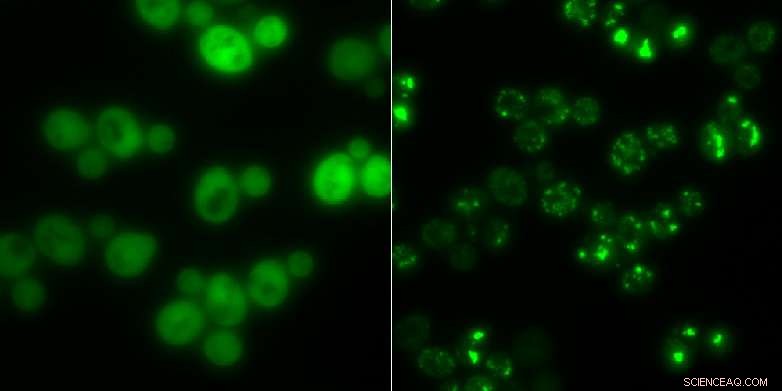
Cellules de levure sans agrégats de protéines (à gauche) et celles avec (taches lumineuses vives) :en période de famine, les amas servent de stockage temporaire pour les protéines. Crédit :Matthias Peter / ETH Zurich
Des chercheurs de l'ETH ont découvert que la formation d'agrégats de protéines dans les cellules de levure est réversible. Cela jette un nouvel éclairage sur les maladies humaines qui peuvent être attribuées à certains agrégats de protéines.
Les agrégats de protéines ont mauvaise réputation. Un certain nombre de maladies humaines, surtout ceux du système nerveux, comme la maladie d'Alzheimer, Parkinson, ou la sclérose latérale amyotrophique (SLA), sont dues à l'agglutination de protéines dégénérées dans les cellules nerveuses, créant des agrégats que les cellules ne peuvent pas dissoudre. Cela provoque la mort des cellules.
Maintenant, des chercheurs dirigés par le professeur de l'ETH Matthias Peter et Reinhard Dechant ont apporté un nouvel éclairage sur les agrégats de protéines dans une étude impliquant des cellules de levure. L'article correspondant vient d'être publié dans la revue Nature Biologie Cellulaire . Dedans, les scientifiques de l'ETH montrent que des amas de protéines se forment dans les cellules de levure en réponse à des facteurs de stress tels que le manque de nutriments ou la chaleur. Si les cellules survivent au stress, ils peuvent à nouveau dissoudre les agrégats, recycler rapidement les composants individuels, et les utiliser pour le métabolisme cellulaire.
Des grumeaux se forment en réponse au stress
La découverte par les chercheurs de l'enzyme Cdc19 est un exemple de protéine qui s'agglutine sous l'effet du stress. L'enzyme fournit de l'énergie aux cellules. Les chercheurs ont découvert que Cdc19 se décompose en quatre sous-unités identiques lors d'une privation de glucose. Ces sous-unités changent ensuite de forme d'origine et s'agglutinent avec d'autres molécules, tels que les acides ribonucléiques ou d'autres enzymes, pour former des agrégats. Les chercheurs appellent ces amas des granules de stress. Une fois intégré dans un agrégat de ce type, Cdc19 devient inactif et n'est plus en mesure de produire du carburant pour la pile. Pendant ce temps, la cellule ne peut ni croître ni se multiplier.
Cependant, le processus est réversible. Dès que le stress est passé, les granules de stress se dissolvent, et les quatre sous-unités de Cdc19 s'assemblent pour que l'enzyme puisse reprendre son rôle dans le métabolisme du glucose.
Les touffes ont un but clair, dit Matthias Peter :« La cellule de levure utilise des agrégats comme une sorte d'entrepôt pour des enzymes importantes, afin que ceux-ci soient protégés de la panne dans les situations de stress et puissent être réactivés immédiatement après que la cellule survit au stress. » Les agrégats, il dit, protéger ces molécules de la dégradation par les mécanismes d'élimination de la cellule. Si la cellule devait à nouveau synthétiser ces composés après chaque situation de stress, cela coûterait beaucoup de temps et d'énergie à la cellule.
Une simple séquence suffit pour agglutiner
Les chercheurs ont également expliqué comment et pourquoi Cdc19 est capable de former des amas. Dans la structure d'un sous-ensemble Cdc19, ils ont identifié un court, sous-section dépliée avec une composition simple. En termes techniques, ces sections sont appelées « régions à faible complexité » (LCR), et les chercheurs disent qu'ils se produisent également dans d'autres protéines formant des agrégats dans d'autres organismes, y compris les humains.
"Les LCR sont exposés en raison de la dégradation du complexe enzymatique et déclenchent le processus d'agrégation, " dit Peter. " Il était donc important pour nous de trouver une séquence de ce genre dans Cdc19. Cela confirme qu'il existe un mécanisme général." A l'état normal de la levure, la LCR du Cdc19 est masquée, ou possède plusieurs groupements phosphate que le LCR "désactive". Ce n'est qu'en cas de stress nutritif que le LCR apparaît et que les groupes phosphate sont éliminés – et ce n'est qu'alors que des agrégats peuvent se former.
Un constat important
"Notre recherche a créé un sentiment d'un nouvel éveil dans la communauté scientifique, " dit Reinhard Dechant, chef de groupe à l'Institut de biochimie, qui a dirigé l'étude avec Matthias Peter. Jusqu'à maintenant, il dit, les agrégats étaient principalement considérés comme des particules pathogènes, car la seule chose visible chez les patients est le résultat du processus, c'est-à-dire plaques de protéines insolubles qui provoquent une maladie. "Notre article examine également le début de l'agrégation et sa progression, " dit Dechant, expliquant que les amas de protéines ne se formeront pas simplement à cause d'une maladie, mais plutôt parce que la cellule en a besoin pour survivre à une situation de stress. "Pour la première fois, nous avons pu montrer que la formation et la décomposition des agrégats sont un mécanisme important dans les cellules. »
D'autres groupes de recherche de l'ETH Zurich examinant les agrégats dans les cellules de levure ont fait des découvertes similaires dans le passé. Par conséquent, d'autres scientifiques de l'ETH ont pu démontrer que des amas de protéines dégénérées fonctionnent, entre autres, comme un souvenir et aide les cellules à stocker les expériences passées (négatives) (comme indiqué dans ETH News). Il apparaît donc que l'agrégation fonctionnelle de certaines protéines est un mécanisme de régulation largement répandu.