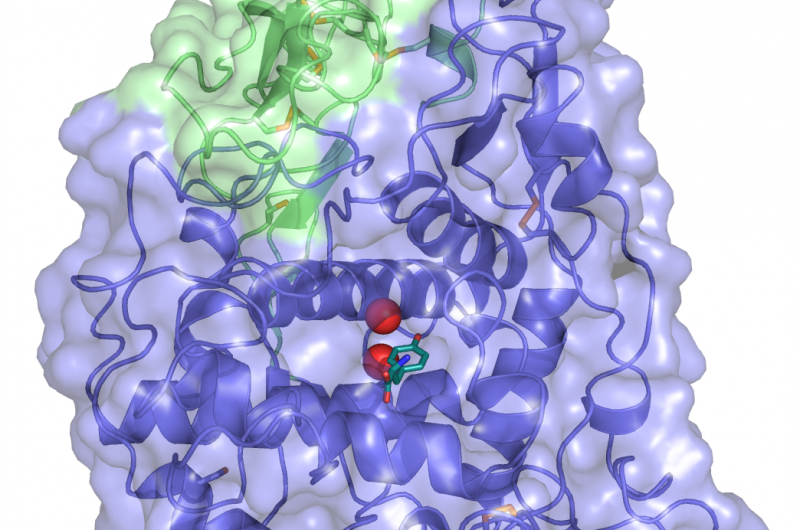
Une structure cristalline de TYRP1. Tyrosine (le substrat métabolisé par TYPR1, de couleur bleu foncé) est lié au site actif, où les ions zinc métal (sphères rouges) coordonnent le rôle fonctionnel. Crédit :Montse Lopez
Une nouvelle percée ouvre des portes pour traiter les affections cutanées liées à la mélanine
Les taches résultant d'une trop grande exposition au soleil et d'autres effets d'une production dysfonctionnelle de mélanine peuvent devenir une chose du passé. Les scientifiques ont résolu la structure de l'une des trois enzymes qui génèrent la mélanine chez l'homme, ouvrant les portes à la conception de composés blanchissants pour éliminer les décolorations de la peau. L'étude a été publiée dans Angewandte Chemie
L'été est souvent synonyme de personnes se prélassant sur les plages pour essayer de bronzer. Avec l'âge et une exposition fréquente au soleil, certaines personnes peuvent avoir les soi-disant « taches de vieillesse » ou « taches du foie », qui sont de petites zones sombres sur la peau. S'en débarrasser est un défi et les chercheurs et l'industrie cosmétique tentent de trouver un moyen de les éliminer à long terme.
Maintenant, une équipe de chercheurs de l'ESRF, L'Université de Groningen et Wageningen Food and Biobased Research (Pays-Bas) vient de déchiffrer l'une des trois enzymes qui génèrent la mélanine, le pigment qui donne la peau, les cheveux et les yeux leur couleur. Lorsque ces enzymes ne fonctionnent pas correctement, elles créent des troubles de la pigmentation :taches sur la peau, albinisme ou mélanome.
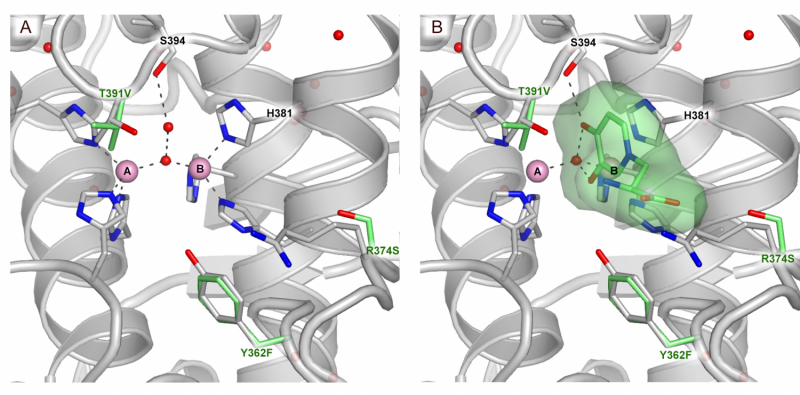
Un mode de liaison au substrat du site actif TYRP1. (A) Site actif du TYRP1 (B) site actif de TYRP1 avec substrat lié. Crédit :@Montse lopez
Jusqu'à aujourd'hui, les structures de ces trois enzymes étaient inconnues, les scientifiques ont donc utilisé les enzymes fongiques ou végétales pour synthétiser des composés ciblant les humains. Le défi de résoudre ces structures réside dans le fait que les scientifiques ne savent pas comment ces enzymes fonctionnent pour produire de la mélanine et qu'ils n'ont jamais réussi à purifier la version humaine en grande quantité pour les étudier.
Résultats inattendus
Xuelei Lai, premier auteur de l'étude, axé sur les enzymes humaines plutôt que sur les enzymes végétales. Il explique que "nous avons réussi à purifier et cristalliser la tyrosinase et la protéine apparentée à la tyrosinase 1 (TYRP1) et nous avons résolu la structure de la TYRP1. C'est la première structure disponible pour une enzyme mélanogénique de mammifère. Nous pensons que si nous suivons la même procédure, nous pourrions probablement résoudre la structure de la tyrosinase et de la protéine 2 liée à la tyrosinase, ces résultats semblent donc très prometteurs dans notre quête pour démêler la manière complexe dont la mélanine est générée".
Les scientifiques ont également dévoilé un résultat inattendu :ils ont découvert que TYRP1 a besoin de zinc pour fonctionner, contrairement à la croyance établie dans la communauté que cette enzyme a besoin de cuivre. "Nous ne savons toujours pas exactement quel rôle le zinc joue dans l'interaction avec TYRP1 et nous avons besoin de recherches approfondies pour le découvrir", explique Montse Soler López, auteur correspondant de l'article et scientifique à l'ESRF.

Montse Soler Lopez, auteur correspondant, Scientifique de l'ESRF au laboratoire de l'ESRF. Crédit :@ESRF
La clé de ce travail est qu'il fournit un véritable modèle pour la conception de composés blanchissants pour éliminer les taches qui apparaissent sur la peau des gens en raison du soleil ou de l'âge. Bauke W. Dijkstra, également auteur correspondant et ancien directeur de recherche à l'ESRF, explique la pertinence de leur travail dans le contexte industriel :« Les entreprises cosmétiques investissent un effort énorme dans ce domaine, nous nous attendons donc à ce que nos conclusions soient une avancée majeure dans le domaine".