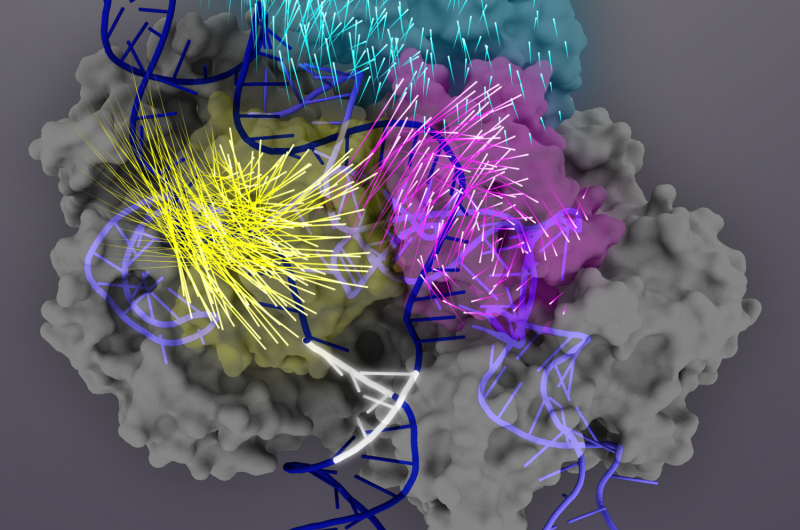
La protéine Cas9 (gris) est une nucléase guidée par l'ARN qui peut être programmée pour se lier et couper toute séquence d'ADN correspondante (double hélice bleu foncé), ce qui en fait un outil puissant pour l'ingénierie du génome. Lors de la liaison cible, Les domaines protéiques Cas9 subissent des réarrangements conformationnels (les mouvements des acides aminés individuels sont représentés par des queues de fusée) pour activer le complexe Cas9-sgRNA pour le clivage cible. Le domaine REC3 (sarcelle) est responsable de la détection de la cible, qui signale la rotation vers l'extérieur du domaine REC2 (magenta) pour ouvrir un chemin pour le domaine de la nucléase HNH (jaune). Cette conformation active de Cas9 est alors capable de déclencher un clivage concerté des deux brins de l'ADN cible. Crédit :Janet Iwasa graphique pour Doudna Lab
Des scientifiques de l'Université de Californie, Berkeley et le Massachusetts General Hospital ont identifié une région clé au sein de la protéine Cas9 qui régit la précision avec laquelle CRISPR-Cas9 se concentre sur une séquence d'ADN cible, et l'ont modifié pour produire un éditeur de gènes hyper-précis avec le plus bas niveau de coupe hors cible à ce jour.
Le domaine protéique que les chercheurs ont identifié comme un contrôleur principal de la coupe de l'ADN est une cible évidente pour la réingénierie afin d'améliorer encore la précision, disent les chercheurs. Cette approche devrait aider les scientifiques à personnaliser les variantes de Cas9 - la protéine qui lie et coupe l'ADN - afin de minimiser le risque que CRISPR-Cas9 modifie l'ADN au mauvais endroit, une considération clé lors de la thérapie génique chez l'homme.
Une stratégie pour améliorer la précision consiste à créer des mutations dans le domaine protéique régissant, appelé REC3, et voyez lesquels améliorent la précision sans affecter l'efficacité de la coupe ciblée.
"Nous avons constaté que même des altérations mineures dans le domaine REC3 de Cas9 affectent le différentiel entre l'édition sur et hors cible, ce qui suggère que ce domaine est un candidat évident pour une mutagenèse en profondeur pour améliorer la spécificité de ciblage. Dans le prolongement de ce travail, on pourrait effectuer une mutagenèse plus impartiale au sein de REC3 que les mutations ciblées que nous avons faites, " a déclaré la co-première auteure Janice Chen, un étudiant diplômé dans le laboratoire de Jennifer Doudna, qui a co-inventé l'outil d'édition de gènes CRISPR-Cas9.
Co-premiers auteurs Chen, Yavuz Dagdas et Benjamin Kleinstiver, et leurs collègues de l'UC Berkeley, Le Massachusetts General Hospital et l'Université Harvard publient leurs résultats en ligne aujourd'hui avant leur publication dans la revue La nature .
Cas9 hyper-précis
Depuis 2012, quand Doudna, professeur de biologie moléculaire et cellulaire et chercheur au Howard Hughes Medical Institute à l'UC Berkeley, et sa collègue Emmanuelle Charpentier de l'Institut Max Planck de biologie des infections ont réutilisé la protéine Cas9 pour créer un produit bon marché, éditeur de gènes précis et simple d'utilisation, les chercheurs ont cherché à réduire les risques d'édition hors cible. Alors que l'amélioration de la fidélité profite à la recherche fondamentale, il est absolument essentiel lors de l'édition de gènes pour des applications cliniques, étant donné que toute coupe d'ADN hors cible pourrait désactiver des gènes clés et conduire à une permanente, effets secondaires inattendus.
Au cours des deux dernières années, deux équipes ont conçu des protéines Cas9 très précises - une à spécificité améliorée appelée eSpCas9(1.1) et une à haute fidélité appelée SpCas9-HF1 - et Chen et Doudna ont cherché à savoir pourquoi ils coupaient avec une spécificité plus élevée que la protéine Cas9 de type sauvage de Streptococcus pyogenes largement utilisé aujourd'hui.
Actuellement, les chercheurs utilisant CRISPR-Cas9 créent un ARN à guide unique (sgRNA) - une molécule d'ARN qui comprend une chaîne de 20 acides ribonucléiques qui complète une séquence d'ADN spécifique de 20 acides nucléiques qu'ils souhaitent cibler - et l'attachent à Cas9. Cet ARN guide permet à Cas9 de se concentrer sur l'ADN complémentaire, lier à elle et couper l'hélice double brin. Mais le complexe Cas9-sgRNA peut également se lier à un ADN qui ne correspond pas exactement, conduisant à une coupe hors cible indésirable.
En 2015, Le laboratoire de Doudna a découvert un commutateur conformationnel de Cas9 qui est activé lorsque le guide ARN et la cible ADN correspondent. Ils ont découvert que ce n'est que lorsque l'ARN et l'ADN correspondent étroitement que la structure 3D de Cas9, en particulier la conformation du domaine HNH nucléase, changer et activer les ciseaux de Cas9. Cependant, le processus responsable de la détection des acides nucléiques en amont du commutateur conformationnel restait inconnu.
Dans l'étude actuelle, Chen et Dagdas ont utilisé une technique appelée FRET à molécule unique (transfert d'énergie de résonance de Förster) pour mesurer avec précision comment les différents domaines protéiques du complexe protéique Cas9-sgRNA - en particulier REC3, REC2 et HNH - se déplacent lorsque le complexe se lie à l'ADN.
Ils ont d'abord déterminé que les avantages de spécificité conférés par eSpCas9(1.1) et SpCas9-HF1 pouvaient s'expliquer par le fait que le seuil du changement de conformation HNH était beaucoup plus élevé pour ces variantes Cas9 que pour la protéine Cas9 de type sauvage, rendant les variantes eSpCas9(1.1) et SpCas9-HF1 moins susceptibles d'activer les ciseaux lorsqu'elles sont liées à une séquence hors cible.
Prochain, ils ont découvert que le domaine REC3 est responsable de la détection de la précision de la liaison cible, qui signale alors la rotation vers l'extérieur du domaine REC2 pour ouvrir un chemin pour le domaine de la nucléase HNH, activer les ciseaux. Cette conformation active de Cas9 est alors capable de cliver les deux brins de l'ADN cible.
Chen, Dagdas et Kleinstiver ont ensuite montré qu'en faisant muter des parties de REC3, il est possible de modifier la spécificité de la protéine Cas9 afin que la nucléase HNH ne soit pas activée à moins que la correspondance ARN guide et ADN cible ne soit très proche. Ils ont pu concevoir un Cas9 hyper-précis amélioré, surnommé HypaCas9, qui conserve son efficacité sur la cible mais est légèrement meilleure pour discriminer entre les sites sur et hors cible dans les cellules humaines.
"Si vous faites muter certains résidus d'acides aminés dans REC3, vous pouvez ajuster l'équilibre entre l'activité sur la cible Cas9 et une spécificité améliorée ; nous avons pu trouver le sweet spot où il y a suffisamment d'activité sur la cible visée mais aussi une forte réduction des événements hors cible, " dit Chen.
En continuant à explorer les relations entre la structure, fonction et dynamique de Cas9, Doudna et son équipe espèrent développer davantage la protéine avec une sensibilité exquise pour effectuer de manière fiable et efficace une variété d'altérations génétiques.