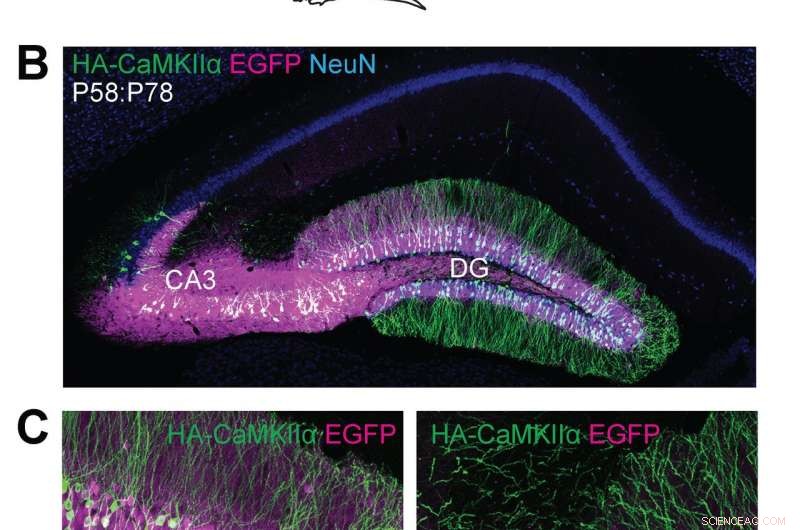
(A) Illustrations schématiques d'expériences. (B, C) Images microscopiques confocales de coupes coronales cérébrales de l'hippocampe de souris Cas9, montrant la fluorescence EGFP (B, C, magenta), immunoréactivités pour NeuN (B, bleu) et la balise HA (B, C, vert) fusionné à l'extrémité N-terminale de CaMKIIα endogène. Crédit:Max Planck Florida Institute for Neuroscience
Les technologies d'édition du génome ont révolutionné la science biomédicale, fournissant un moyen rapide et facile de modifier les gènes. Cependant, la technique permettant aux scientifiques d'effectuer les montages les plus précis, ne fonctionne pas dans les cellules qui ne se divisent plus, ce qui inclut la plupart des neurones du cerveau. Cette technologie avait une utilisation limitée dans la recherche sur le cerveau, jusqu'à maintenant. Chercheur associé Jun Nishiyama, MARYLAND., Doctorat., Chercheur, Takayasu Mikuni, MARYLAND., Doctorat., et directeur scientifique, Ryohei Yasuda, doctorat au Max Planck Florida Institute for Neuroscience (MPFI) ont développé un nouvel outil qui, pour la première fois, permet une édition précise du génome dans les neurones matures, ouvrant de vastes nouvelles possibilités dans la recherche en neurosciences.
Cet outil nouveau et puissant utilise la technologie d'édition de gènes récemment découverte de CRISPR-Cas9, un mécanisme de défense virale trouvé à l'origine dans les bactéries. Lorsqu'il est placé à l'intérieur d'une cellule telle qu'un neurone, le système CRISPR-Cas9 agit pour endommager l'ADN dans un endroit spécifiquement ciblé. La cellule répare ensuite ces dommages en utilisant principalement deux méthodes opposées; l'un étant la jonction d'extrémités non homologues (NHEJ), qui a tendance à être source d'erreurs, et réparation dirigée par homologie (HDR), qui est très précis et capable de subir des insertions de gènes spécifiées. HDR est la méthode la plus désirée, permettant aux chercheurs la flexibilité d'ajouter, modifier, ou supprimer des gènes selon le but recherché.
Amener les cellules du cerveau à utiliser préférentiellement le mécanisme de réparation de l'ADN HDR a été plutôt difficile. On pensait à l'origine que le HDR n'était disponible que comme voie de réparation pour les cellules en prolifération active dans le corps. Lorsque les cellules cérébrales précurseurs deviennent des neurones, elles sont appelées cellules post-mitotiques ou non en division, rendant le cerveau mature largement inaccessible au HDR - c'est du moins ce que les chercheurs pensaient auparavant. L'équipe a maintenant montré qu'il est possible pour les neurones post-mitotiques du cerveau de subir activement une HDR, en appelant la stratégie "vSLENDR (marquage unicellulaire à médiation virale de protéines endogènes par réparation dirigée par homologie à médiation CRISPR-Cas9)." La clé essentielle du succès de ce processus est l'utilisation combinée de CRISPR-Cas9 et d'un virus.
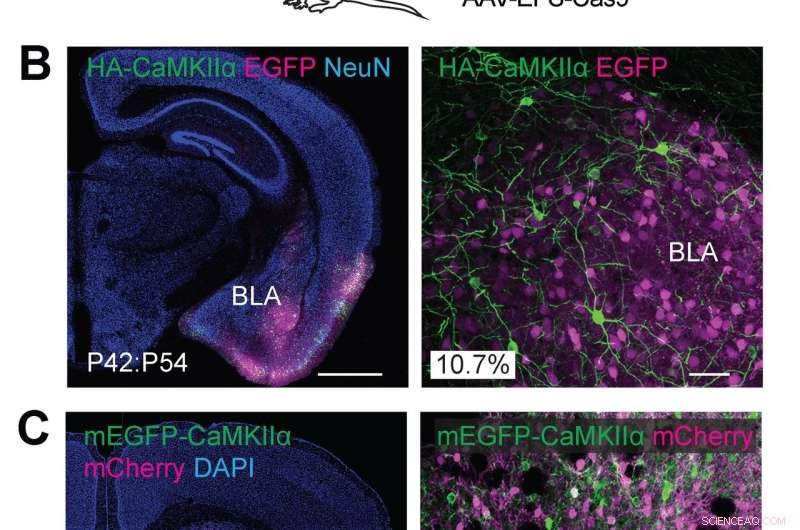
(A) Illustrations schématiques d'expériences. (B) Images microscopiques confocales de coupes coronales du cerveau de l'amygdale de souris de type sauvage, montrant la fluorescence EGFP (B, magenta), immunoréactivités pour NeuN (gauche) et le tag HA (vert) fusionné à l'extrémité N-terminale de CaMKIIα endogène. (C) Images microscopiques confocales de coupes coronales du cerveau du striatum de souris de type sauvage, montrant le signal DAPI (à gauche), la fluorescence mCherry (magenta), la fluorescence mEGFP (verte) fusionnée à l'extrémité N-terminale de CaMKIIα endogène. Crédit:Max Planck Florida Institute for Neuroscience
Le virus adéno-associé (AAV) est un virus faiblement immunogène, virus non toxique utilisé par les scientifiques comme mécanisme de livraison efficace pour toutes sortes de gènes. Ce virus peut efficacement fournir le modèle de donneur nécessaire pour le HDR, augmentant son efficacité. L'équipe a d'abord emballé la machinerie nécessaire pour l'édition du génome dans l'AAV et l'a livrée aux neurones de souris transgéniques exprimant Cas9, obtenir une HDR spectaculairement efficace dans les neurones post-mitotiques du cerveau.
Ils ont ensuite créé un système à double virus leur permettant d'utiliser la technologie chez des animaux qui n'avaient pas été conçus pour exprimer Cas9. Ils ont testé ce système à double virus dans un modèle murin âgé de la maladie d'Alzheimer, montrant que la technique vSLENDR peut être applicable dans des modèles pathologiques même à un âge avancé.