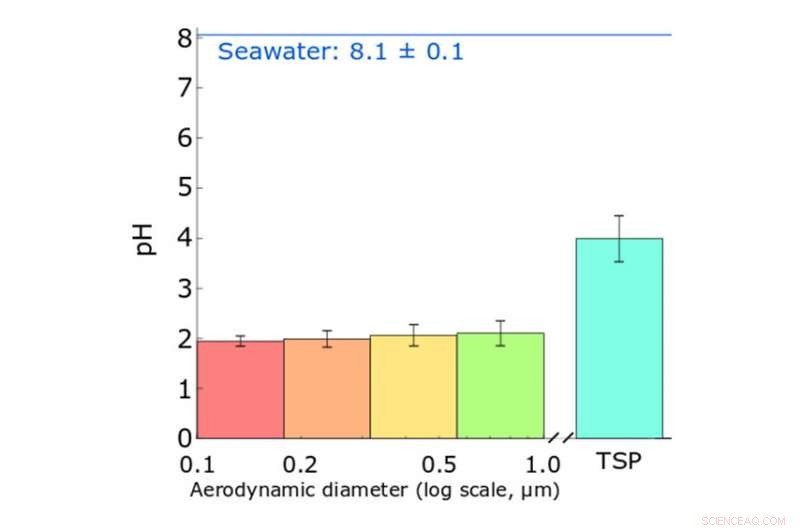
Graphique montrant comment les aérosols des embruns marins sont plus acides que l'eau de mer. « pH » est une mesure de l'acidité, avec une diminution d'une unité de pH signifiant une augmentation de l'acidité d'un facteur 10. Les quatre barres de gauche montrent le pH des petits aérosols, et « TSP » fait référence aux « particules totales en suspension, » qui sont principalement de gros aérosols. Crédit : Angle et al., Actes de l'Académie nationale des sciences , ETATS-UNIS, 2020
Les aérosols sont partout. Ces minuscules particules liquides ou solides peuplent l'atmosphère, émergeant de sources naturelles et artificielles comme les volcans et les océans, et les combustibles fossiles et l'agriculture. D'une taille allant de moins que la largeur du plus petit virus à environ le diamètre d'un cheveu humain, les aérosols ont un impact puissant sur le climat et la santé humaine.
Les aérosols peuvent également être décrits comme un réchauffement, comme dans la suie noire, ou refroidissement, comme dans les embruns. Vicki Grassian, professeur distingué de chimie et de biochimie à l'UC San Diego, et l'étudiant diplômé Kyle Angle ont étudié la version cool, montrant que les aérosols d'embruns marins deviennent plus acides dans les deux minutes suivant leur création.
Les aérosols d'embruns marins naissent lorsque des bulles éclatent et que les vagues s'écrasent à la surface de l'océan. Avant cette étude, les scientifiques pensaient que les particules aqueuses, une fois produit, ont pris leur temps - des jours ou des semaines - pour devenir "aigre". Mais Grassian et Angle, avec une équipe de chercheurs du Centre d'Impacts des Aérosols sur la Chimie de l'Environnement (CAICE), y compris des chercheurs de l'UC San Diego, Université d'État du Colorado, Université du Wisconsin-Madison et UC Davis, ont démontré que l'acidité des aérosols dépend également de la taille :les particules plus petites sont plus acides que les plus grosses.
"Les plus petites particules deviennent 100, 000 fois plus acide que l'océan en deux minutes, " dit Angle, premier auteur de l'article publié en ligne dans la revue Actes de l'Académie nationale des sciences . "Je m'attendais à ce que cela se produise pour les particules qui interagissent avec la pollution depuis des jours, mais le voir pour les embruns frais était une découverte intéressante."
La découverte, selon Angle, est chimiquement important car les propriétés et la réactivité des aérosols changent avec l'acidité des particules. Par exemple, le polluant nocif dioxyde de soufre est oxydé en sulfate plus rapidement à l'interface des aérosols acides. Le sulfate peut continuer à agir comme une graine de nuage dans l'atmosphère. La communauté scientifique, donc, cherche à comprendre ces transformations afin de prédire la formation des nuages et finalement de comprendre le changement climatique.
Pour le grand public, ces résultats ont des implications importantes pour la qualité de l'air. "Plus de particules acides peuvent augmenter le stress pulmonaire, il faut donc comprendre les causes des aérosols acides, " dit Angle.
Le test décisif
Les bases de la conduite de cette recherche, comme dans les laboratoires de chimie du lycée, impliquait le test décisif, utilisé pour déterminer si une substance est acide ou basique/alcaline.
« Si vous avez trempé du papier de tournesol dans du jus de citron ou du vinaigre, il deviendrait rouge, vous disant que ces liquides sont acides. Si vous l'avez plongé dans l'eau de mer, il deviendrait bleu, parce que l'océan est plus alcalin, " a expliqué Angle. " Quand j'ai séparé les aérosols d'embruns marins en fonction de leur taille et que je leur ai appliqué du papier de tournesol, J'ai trouvé que les gros sont aussi acides que le jus de tomate et les petits aussi acides que le jus de citron. Cela montre que les particules produites à partir de l'eau de mer ont un pH différent de celui de l'eau de mer d'origine."
Selon Grassian, il s'agit d'une découverte inattendue qui ajoute à la compréhension des aérosols d'embruns marins, une composante importante de l'atmosphère terrestre.